某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为__________________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ =" _____" Mn2+ + _____ CO2↑ + _____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):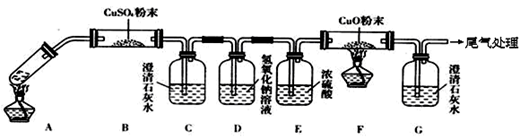
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。
乙二酸分解的化学方程式为_____________________________________。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是__________________。(用文字简单表述)
(5)以上溶液中各离子的浓度由大到小的顺序为:_____________________________;(用离子符号表示)
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)写出G的含氧官能团的名称 ;B→C的反应类型是 。
(2)写出D E的化学方程式: 。
E的化学方程式: 。
(3)满足下列条件的D的同分异构体有 种。
①能发生银镜反应;②能使FeCl3溶液显色;③酯类。
(4)下列关于G的说法正确的是
a.能使溴水褪色
b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应
d.分子式是C9H8O3
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。
a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为 ;
②链烃A与溴的CCl4溶液反应生成B,B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式:;
③B与足量NaOH水溶液完全反应,生成有机物E,该反应的化学方程式:;E与乙二醇的关系是。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3∶2∶1,则A的名称为。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为。
某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为136。
方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1∶1∶1∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱,如下图B。

(1)分子中共有 种化学环境不同的氢原子。
(2)A的分子式为 。
(3)该物质属于哪一类有机物 。
(4)A的分子中只含一个甲基的依据是 (填序号)。
a.A的相对分子质量
b.A的分子式
c.A的核磁共振氢谱图
d.A分子的红外光谱图
(5)A的结构简式为 。
(6)A的芳香类同分异构体有多种,其中又同时符合下列条件:①能发生水解反应;②分子结构中含有一个甲基。则该芳香类A的同分异构体共有 种。
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
8SO2+2Fe2O3,该反应中被氧化的元素是 (填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为 L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是。
②实验过程中,需要通入氧气。试写出一个用如图所示装置制取氧气的化学方程式。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
Na2S2O3·5H2O 俗称“海波”,是常用的脱氧剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃ 和70 ℃ 时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2SO3+S Na2S2O3
Na2S2O3
制备海波的流程:
(1)实验开始时用1 mL乙醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫磺的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是 。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液 C.水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol/L的标准碘水溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定反应方程式为:I2+2Na2S2O3 2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。
2NaI+Na2S4O6。产品中的Na2S2O3·5H2O的纯度为 %。