甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a="________ " b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1, B元素原子M层上的电子数和K层上的电子数相同。B单质与D单质反应后可形成化合物BD2;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是A_______;B______;C_______;D______;E________。
(2)写出A单质在D单质中燃烧的化学方程式:_____________________。
(3)写出A最高价氧化物的水化物的溶液与只由C、E两种元素组成的固体化合物反应的离子方程式:___________________________________________。
在①35Cl、②37Cl—、③12C、④23Na+、⑤24Mg2+、⑥14C中;(用序号回答下列问题)
(1)粒子半径比较:①_____②;④_____⑤(填 < = > 号)
(2)微粒中质子数等于中子数的是____________,核外电子数相等的微粒______ ______;
(3)_________与_________互为同位素,共有___________种元素。
下表是元素周期表的一部分,回答下列有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑦ |
⑧ |
|||||
| 3 |
① |
③ |
④ |
⑥ |
⑨ |
⑩ |
||
| 4 |
② |
(1)写出⑦单质分子的化学式;画出负2价的 ⑨离子结构示意图;
写出⑩单质与水反应的离子方程式:。
(2) ①~⑩元素中最高价氧化物的水化物碱性最强的是________(填化学式)。
①、③、④简单阳离子按离子半径由大到小的顺序排列为_________(用离子符号表示)。
(3)写出①、⑧元素按1:1的原子比例组成的化合物与⑤的最高价氧化物反应的化学方程式:。
(4) X元素①~⑩元素中的其一种,其氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应。
则 :X的元素符号是,它位于元素周期表的位置。
X的氢氧化物与盐酸反应的离子方程式。
(5)①与③化学性质较活泼的是_____,(元素符号)设计实验证明:________________________________________________________________________________________________________(简述实验操作步骤及现象)
氨气在工农业有着广泛的用途。已知25%氨水的密度为0.91 g/cm3,5%氨水的密度为0.98 g/cm3。
1、(1)配制100mL 2.5mol/L氨水需要浓度为25%氨水______mL(保留2位小数)。
(2)若将上述两溶液等体积混合,所得氨水溶液的质量分数是_____________。
A.等于15% B.大于15% C.小于15% D.无法估算
2、已知:4NH3+O2 4NO+6NO,4NO+3O2+2H2O
4NO+6NO,4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80。
(1)a mol NO完全转化为HNO3理论上需要氧气_____________mol。
(2)为使NH3恰好完全氧化为NO,氨-空气混合气体中氨的体积分数(用小数表示)为_____________(保留2位小数)。
(3)20.0 mol NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量硝酸,以及其他成分(高温下NO与O2不化合)。计算氨转化为NO和HNO3的转化率。
(4)20.0 mol NH3和一定量空气充分反应后,再转化为硝酸。通过计算,在图中画出HNO3的物质的量n(A)和空气的物质的量n (B)关系的理论曲线。
煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:C+H2O CO↑+H2↑。甲
CO↑+H2↑。甲
酸苯丙酯(F)是生产香料和药物的主要原料。下图是用煤为原料合成甲酸苯丙酯的路线图(部分反应条件和生成物已略去)其中D的分子式为C9H10O,且能发生银镜反应。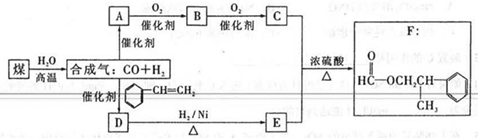
根据上述转化关系回答下列问题:
(1)写出A、D的结构简式:
A:________________________ D:__________________________
(2)D→E的反应类型为_____________,B中的官能团是_____________。
(3)写山检验B中的官能团的试剂及出现的现象。
试剂_____________,现象_______________________________________。
(4)写出C与E反应生成F的化学方程式_______________________________________。
(5) “合成气”( CO、H2)除作合成有机物的原料外,还有其它用途,如_____________(举两例)。
(6)F有多种同分异构体,写出满足下列条件的两种同分异构体的结构简式。
①属于酯类,且能发生银镜反应。②苯环上的一氯取代物只有两种结构。
③分子结构中只有两个甲基。
_______________________________________、_______________________________________