可逆反应的特点是同一反应,能同时向相反的两个方向,充分反应后最终各种物质共存在一起。现将0.2molSO3放在某密闭容器中加热使其分解:2SO3 2SO2+O2。
2SO2+O2。
(1)容器中SO2与O2分子数目比为___________,质量比为__________
(2)最终容器内硫原子与氧原子个数比为__________
(3)反应中,气体分子数目_________(填增加、减少、不变),将充分反应后的混合气体通入适量的BaCl2溶液中,生成的沉淀是_____________;若是通入到足量的NaOH 溶液中,则生成的盐化学式为________________________
写出钢铁生锈的电极反应式(水膜呈中性):
负极___________________________
正极___________________________
酸雨的pH______(>,<,=)5.6,写出形成硫酸型酸雨的相关的化学方程式:
二氧化硫与雨水反应___________________________,再被氧化成硫酸 .
胃舒平(主要成分为Al(OH)3)能够治疗胃酸过多,反应的化学方程式是
_________________________________________。
中国卫生部部长陈竺表示,中国甲型H1N1流感疫苗接种方案的原则已经确立:要首先保护最为易感和脆弱的人群,特别是中学生、有基础性疾病(如糖尿病)的人、一线的公共服务人员。请根据这一主题和题意回答下列问题。(用下列选项的字母代号填空)
| A.蛋白质 |
| B.强氧化性 |
| C.葡萄糖 |
| D.变性 |
E.强酸性
F.淀粉
G.盐析
H.强还原性
(1)糖尿病是因为病人的尿液中含而得名的。
(2)甲型H1N1流感病毒和疫苗都含有。
(3)为预防甲型H1Nl流感.可用具有的NaClO溶液进行环境消毒。
(4)烹制猪肉时温度达到71℃,就可杀死细菌和病毒。这是因为细菌和病毒发生了。
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。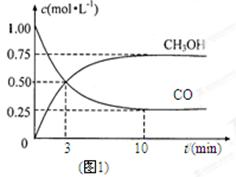
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=; H2的平衡转化率为_________________________。
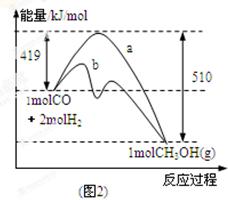
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式。
(3)该温度下,反应平衡常数K=______(填数值)。
(4)恒容条件下,下列措施中能使反应体系中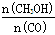 增大的措施有。
增大的措施有。
| A.升高温度 | B.充入He气 |
| C.再充入2 molH2 | D.使用催化剂 |