从海水中可以获得淡水、食盐,并可提取镁和溴等物质;其中海水淡化的常用方法主要有 (填一种)。
从海水中提取溴和镁的流程如下图所示: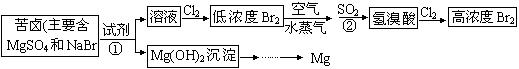
(1)提取Br2时第一次通入Cl2后发生反应的离子方程式是 ;反应中②中SO2表现出___ (填“氧化”或“还原”)性;
第二次通入Cl2后,要提取Br2还要进行的操作为 ]
(2)为了实现对镁离子的富集,①中加入的足量试剂是 _____ (填化学式);
试从节约能源,提高金属镁的纯度分析,以下最适宜的冶炼的方法是 (填字母)。
A.Mg(OH)2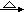 MgO MgO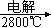 Mg Mg |
B.Mg(OH)2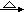 MgO MgO Mg Mg |
C.Mg(OH)2 无水MgCl2 无水MgCl2 Mg Mg |
D.Mg(OH)2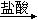 MgCl2溶液 MgCl2溶液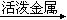 Mg Mg |
某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究某孔雀石[化学式为aCuCO3·bCu(OH)2,a、b为正整数]中各元素的质量关系。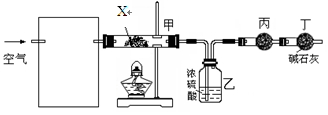
①为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;(注:碱石灰可看作烧碱和生石灰的混合物)
②向装置中鼓入空气的目的是__ ________;
丙装置中药品的名称为________,
实验时,该药品未见明显变化,证明____________________________________________;
③连续两次加热、鼓气、冷却、称量甲装置的质量,质量差不超过0.1 g,判断该孔雀石已完全分解。
④更精确的测定得出如下数据:孔雀石受热后完全分解,固体由16.52 g变为12.00 g,装置乙增重1.44 g。写出该孔雀石的化学式________________________。
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行,请把合适的答案编号都挑选出来)
| A.[(b-a)/84]×22.4×1000 mL |
| B.[(b-c)/31]×22.4×1000 mL |
| C.[(c-a)/106]×22.4×1000 mL |
| D.[(c-a)/106]×2×22.4×1000 mL |
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】用葡萄糖制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(1)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:。甲同学还发现用同浓度FeCl3,Fe(NO3)3溶解银镜,FeC l3溶液溶解Ag的反应更快更完全,请解释其原因:
l3溶液溶解Ag的反应更快更完全,请解释其原因:
(2)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
【思考与交流】
(3)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论,并简述理由:。
(Ⅰ)“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验””(夹持装置未画出),判断下列说法正确的是( )
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |
(Ⅱ)利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
| (1) |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
| (2) |
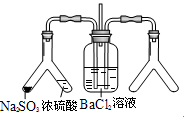 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
| (3) |
 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,气体读数已折算成标准状况下的数值)。 |
(一)(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象: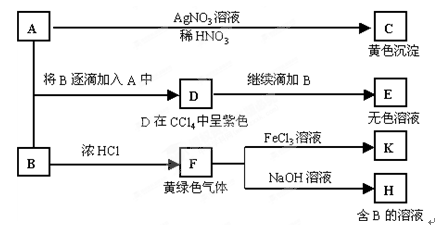
请回答:
(1)写出A、B和C的化学式:A,B,C。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
,。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式:。