现有一定量的铁粉和铜粉的混合物,将其平均分成四等份,分别加入同浓度不同体积的稀硝酸,充分反应后,在标准状况下生成NO的体积和剩余金属的质量如下表(假设硝酸的还原产物只有NO一种):
| 编号 |
① |
② |
③ |
④ |
| 稀硝酸体积/mL |
100 |
200 |
300 |
400 |
| 剩余金属/g |
18.0 |
9.6 |
0 |
0 |
| NO体积/mL |
2240 |
4480 |
6720 |
V |
根据上表中的数据计算分析,下列推断正确的是( )
A.①中溶解了5.6 g Fe B.②中溶解了9.6 g Cu
C.硝酸的浓度为4 mol/L D.④中V = 6720
【原创】生活中处处有化学。下列说法正确的是
| A.油脂、淀粉、纤维素以及蛋白质均可作为人类的营养物质 |
| B.乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| C.乙醇、乙酸和甲醛广泛应用于食品加工 |
| D.将氯气通入澄清石灰水中制漂白粉 |
某反应:2A(g) 3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是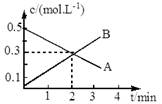
A.v(A)=0.1mol/(L.min)
B.v(B)=0.2mol/(L.min)
C.v(A)=" v(B)" ="0.5" mol/(L.min)
D.v(A)=" v(B)" ="0.3" mol/(L.min)
铜锌原电池装置(见图),下列分析正确的是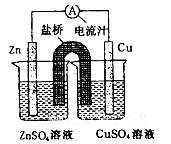
| A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小 |
| B.原电池工作时,Cu电极流出电子,发生氧化反应 |
| C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
室温下,用0.100mol/L 盐酸溶液滴定20.00mL 0.100mol/L的某氨水溶液,滴定曲线如图所示,下列有关说法不正确的是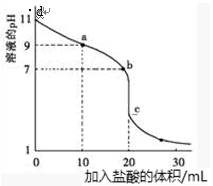
| A.曲线上除d点外任意一点所示溶液中:c(NH4+ )+c(H+)= c(Cl—)+ c(OH-) |
| B.a点所示溶液中, c(Cl— ) > c(NH4+ )> c(NH3·H2O)> c(OH-)> c(H+) |
| C.b点所示溶液中,c(NH4+ )= c(Cl— ) |
| D.c点所示溶液中, c(Cl— ) > c(NH4+ ) > c(H+)>c(NH3·H2O) |
下列关于酸性氧化物、碱性氧化物、单质、混合物的分类中,正确的是
| 酸性氧化物 |
碱性氧化物 |
单质 |
混合物 |
|
| A |
干冰 |
Na2O |
金刚石 |
浓盐酸 |
| B |
CO |
Fe3O4 |
溴 |
漂白粉 |
| C |
SO2 |
Na2O2 |
石墨 |
福尔马林 |
| D |
SO3 |
Fe2O3 |
硫黄 |
FeSO4·7H2O |