判断下列化学基本概念的依据不正确的是
| A.溶液的酸碱性:溶液中c(H+)和c(OH-)的相对大小 |
| B.强弱电解质:溶液的导电能力大小 |
| C.离子化合物:化合物中是否含离子键 |
| D.氧化还原反应:元素化合价是否变化 |
下列事实不能用勒夏特列原理解释的是
| A.用排饱和食盐水法收集Cl2 |
| B.温度控制在500℃有利于合成氨反应 |
| C.打开碳酸饮料会有大量气泡冒出 |
D.工业制钾 Na(l)+KCl(l)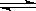 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是△H=—283.0 kJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的ΔH=—(2×283.0)kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
在一恒容密闭烧瓶中注入NO2,在25℃时建立平衡:2NO2 N2O4△H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是
N2O4△H<0。若把烧瓶置于100℃的沸水中,下列情况:①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是
| A.③⑤ | B.③④ | C.②④ | D.①③ |
某温度下按如图安装好实验装置,在锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol·L-1的硫酸,将产生的H2收集在一个注射器中,用时10 s时恰好收集到气体的体积为50 mL(若折合成0℃、101 kPa条件下的H2体积为44.8 mL),在该温度下下列说法不正确的是
| A.用锌粒表示10 s内该反应的速率为0.013 g·s-1 |
| B.忽略锥形瓶溶液体积的变化,用H+来表示10 s内该反应的速率0.01 mol·(L·s)-1 |
| C.忽略锥形瓶内溶液体积的变化,用Zn2+来表示10 s内反应的速率0.01 mol·(L·s)-1 |
| D.用H2表示10 s内该反应的速率为0.004 mol·(L·s)-1 |
在反应3H2 + N2 2NH3中,经一段时间后,氨的浓度增加了0.6mol / L,在此时间内用H2表示的平均反应速率为0.45mol / (L.s),则反应所经过的时间为
2NH3中,经一段时间后,氨的浓度增加了0.6mol / L,在此时间内用H2表示的平均反应速率为0.45mol / (L.s),则反应所经过的时间为
| A.0.44s | B.1s | C.0.33s | D.2s |