锂离子电池的广泛应用使回收利用锂资源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 2.5mol·L-1的H2SO4溶液。正极材料中的锂经反应③和④完全转化为Li2CO3,至少有 g Na2CO3参加了反应。
实验室模拟合成氨和氨催化氧化的流程如下: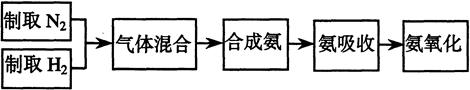
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置: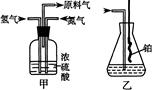
氮气、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨,(“会”或“不会”)发生倒吸,原因是:。
(4)写出乙装置中氨催化氧化的化学方程式:
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、、离子。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度:mol/L
实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
(1)如何检查装置A的气密性_________________________________________
(2)为了安全,在点燃D处的酒精灯之前,在b处必须_____________________。
(3) 装置B的作用是_______________ ,装置C中装的液体是________________,所起的作用是_______________________。
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双管中发生的化学反应方程式是________________________________________。
(5)若FeO和Fe2O3固体混合物的质量为31. 2g,反应完全后,U型管的质量增加9.9g则混合物中Fe2O3的质量为______________。
(6)U型管E右边连接干燥管F的目的是______________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”、“偏小”或“无影响”)
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: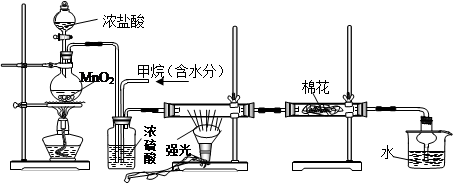
A B C D E
(1)写出A装置中发生反应的离子方程式
(2)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(3)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应≥
(4)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有溶液。
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出反应的化学方程式。
(6) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为(填字母)。
A.水洗分液法 B.蒸馏法 C.过滤法 D.结晶法
(7) 该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为(填字母)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、 、Mg2+、
、Mg2+、 、Ba2+、
、Ba2+、 。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
。将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
注: + OH- = NH3↑+ H2O
+ OH- = NH3↑+ H2O
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol/L) |
(3)试确定K+是否存在?(填“是”或“否”),判断的理是。用什么样的方法可以验证K+是否存在:。