化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。加入过量稀盐酸时观察到的现象是______________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有 __。
(4)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________________________________。
实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,错误的是____________________(填写序号)。
a. 用纸槽往试管里装粉末状药品时,试管应先横放再直立
b. 称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c. 试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要450mL 0.1mol·L-1NaOH溶液和500mL 0.5 mol·L-1硫酸溶液。请回答下
列问题:
①在右图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有。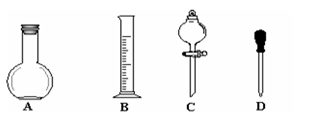
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制450 mL 0.1 mol·L-1 NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为________g。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容
量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与
刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。
④根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL,如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
(12分)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1) 已知草酸(H2C2O4)晶体分解的化学方程式为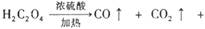
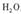 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。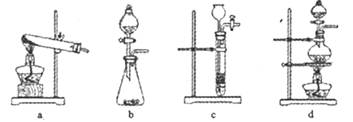
(2) 某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3? nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。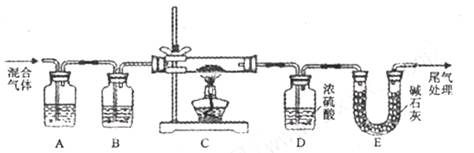
①为得到干燥、纯净的CO气体,洗气瓶A中盛放的液态试剂是________ (填编号)。
a.浓硫酸b.饱和碳酸氢钠溶液c.氢氧化钠溶液d.氯化钙溶液
②在点燃C处酒楮灯之前应进行的操作是:(a)检查装置气密性;(b) ________________
③某同学认为铁锈样品与硝酸反应产物中除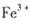 外还可能含有
外还可能含有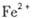 。若要确认其中的
。若要确认其中的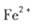 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。
a. KSCN溶液和氯水 b.铁粉和KSCN溶液 C.浓氨水 d.酸性KMnO4溶液
④在本实验中,下列情况会使测定结果n偏大的是________ ________ (填编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3? nH2O
⑤准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n =________。
I.右图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
①Vml该浓盐酸中Cl_的物质的量为
②取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。
A.溶液中HCl的物质的量 B.溶液中Cl-的数目
C.H+的物质的量浓度 D.溶液的密度
II、现有失去标签的四瓶无色溶液A、B、C、D,只知道它们是K2CO3、K2SO4、K HSO4和Ba(NO3)2,为了鉴别它们,进行如下实验:
①.A+D 溶液+气体 ②.B+C
溶液+气体 ②.B+C 溶液+沉淀
溶液+沉淀
③.B+D 溶液+沉淀 ④.A+B
溶液+沉淀 ④.A+B 溶液+沉淀
溶液+沉淀
⑤.将④得到的沉淀物加入③所得溶液中,④中沉淀很快溶解并产生无色无味的气味。
根据以上实验事实,B、D分别为______、_____(用化学式表示).
某校化学兴趣小组拟用浓盐酸与二氧化锰加热反应,制取并收集2瓶干燥.纯净的氯气。为防止换集气瓶时生成的氯气污染空气,设计了如下装置: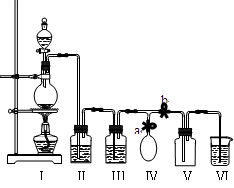
(1)写出Ⅰ装置烧瓶中发生的反应的离子方程式:。
(2)装置Ⅱ中盛放的药品是饱和氯化钠溶液,其作用是 ;装置Ⅲ的作用是干燥氯气,应盛放___________。
(3)实验开始后,先ab(填“关闭”或“打开”,下同);当集满一瓶氯气时,为减少换集气瓶时氯气的外溢,再ab,换好集气瓶后,继续收集氯气
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中不恰当的是(填序号)。
A.氢氧化钠溶液 B.浓硫酸 C.水
(9分)为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空:
⑴图中瓶II的作用是______________________________。
⑵对实验装置尚有如下A、B、C、D四种观点,你认为合理的是________。(填代号)
A.在E处增加CaCl2干燥管 B.在F处增加CaCl2燥管
C.在E和F两处增加CaCl2干燥管 D.不必增加干燥管
⑶将插入溶液的管子末端改成具有多孔的球泡(图中的III),有利于提高实验的准确度,
其理由是__________________________________________。
⑷实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气
体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式)___________。
⑸为防止实验中若猛吸猛呼,会造成不安全后果,将实验装置如何改进。