(12分)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1) 已知草酸(H2C2O4)晶体分解的化学方程式为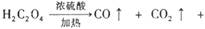
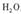 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。
(2) 某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3? nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。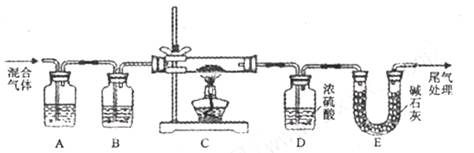
①为得到干燥、纯净的CO气体,洗气瓶A中盛放的液态试剂是________ (填编号)。
a.浓硫酸 b.饱和碳酸氢钠溶液 c.氢氧化钠溶液 d.氯化钙溶液
②在点燃C处酒楮灯之前应进行的操作是:(a)检查装置气密性;(b) ________________
③某同学认为铁锈样品与硝酸反应产物中除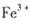 外还可能含有
外还可能含有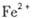 。若要确认其中的
。若要确认其中的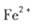 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。
a. KSCN溶液和氯水 b.铁粉和KSCN溶液 C.浓氨水 d.酸性KMnO4溶液
④在本实验中,下列情况会使测定结果n偏大的是________ ________ (填编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3? nH2O
⑤准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n =________。
(共6分,每空1分)用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示。
| 实验编号 |
待测NaOH溶液的体积/mL |
HCl溶液的体积/mL |
| 1 |
25.00 |
26.40 |
| 2 |
25.00 |
24.38 |
| 3 |
25.00 |
24.42 |
试回答下列问题:
(1)使用酚酞做指示剂,滴定过程中两眼应该注视_________________,滴定终点的判断是。
(2)实验中,指示剂加2滴不能多加是因为:
(3)未知浓度的NaOH溶液的物质的量浓度为mol/L。(精确到0.0001)
(4)有下列错误操作:
①酸式滴定管用蒸馏水洗净后,未经标准溶液润洗就注入标准的盐酸溶液
②用碱式滴定管取用待测液前,尖嘴部分有气泡,取用过程中气泡消失
③滴定前,读取酸液体积时视线低于酸式滴定管的液面,滴定后读出酸液的体积时,
视线高于酸式滴定管的液面
④锥形瓶用待测液润洗两次
哪些错误操作会使NaOH浓度的测定值偏低?答:_____________。
哪些错误操作会使NaOH浓度的测定值偏高?答:_____________。
(共12分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d有气体产生,两极上共收集到336mL(标准状态)气体。回答: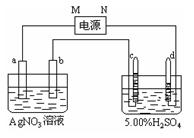
(1)直流电源中,M为极。
(2)Pt电极上生成的物质是,其质量为 __g。(1分+2分)
(3)电源输出的电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶ ∶∶ 。
(4)AgNO3溶液的浓度(填“增大”、“减小”或“不变”。下同),AgNO3溶液的pH,H2SO4溶液的浓度,H2SO4溶液的pH _。(每空1分)
(5)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液质量为g。
氧化二氯是棕黄色刺激性气体,熔点:—116℃,沸点3.8℃。氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100),同时反应生成次氯酸溶液;制备出之后要冷却成固态以便操作和贮存。制备少量Cl2O,是用干燥的氯气和HgO反应(还生成HgO•HgCl2)。装置示意如图(铁架台和夹持仪器已略去)。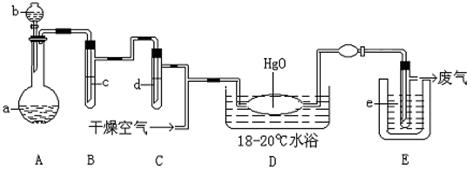
(1)A中盛有的深色固体试剂a是,分液漏斗中试剂b是
(2)B中盛有液体c是,C中的液体d是
(3)D中所发生反应的化学方程式是
(4)E中的保温瓶中盛有致冷剂,它应是(在干冰、冰水、液态空气中选择),在E的内管得到的氧化二氯中可能含有杂质是
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是,用这些不同的连接方式的主要理由是。
[选修—化学与技术]
氟化钠是一种微溶于水的盐,实验室可通过图22所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
已知:20℃时氯化铵的溶解度为37.2g,Na2SiF6微溶于水,请回答下列问题:
(1)上述流程中①②分别发生化学反应,写出相关的化学方程式:
①;
②;
(2)请指出I—IV实验操作的名称;操作I,操作II,操作III,操作IV。
(3)操作II的具体过程是。
(4)流程①中的NH4HCO3必须过量,其原因的是。
有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图12提供的装置确定该样品的成分及Na2SO3的质量分数。称此样品6.30g,加入6.0mol·L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色。请回答下列问题:
(1)溶液X是,煤油的作用是。
(2)若实验中加入硫酸溶液的体积为5.00mL,则样品中Na2SO3的质量分数是,
写出有关离子方程式。
(3)结合已提供的实验仪器,设计实验(实验仪器自选)如何正确测出气体的体积,简述操作步骤:
。
(4)说明一定含有硫酸钠的依据: 。
。