下列离子方程式或化学方程式书写正确的是
A.2AlCl3(熔融)  2Al + 3Cl2↑ 2Al + 3Cl2↑ |
B.电解CuCl2溶液:2Cu2+ + 2H2O 2Cu + 4H+ + O2↑ 2Cu + 4H+ + O2↑ |
C.硫酸氢铵溶液与足量烧碱稀溶液共热:NH4+ + H++ 2OH- 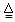 NH3↑+ 2H2O NH3↑+ 2H2O |
| D.氯化铁溶液中通入足量H2S气体:2Fe3+ + 3H2S = 2FeS↓ + S↓ + 6H+ |
洗涤BaSO4固体中吸附的Na+和Cl—,最好用下列试剂中的
| A.BaCl2溶液 | B.稀H2SO4 | C.Na2SO4溶液 | D.蒸馏水 |
X、Y为短周期元素,X、Y可形成化合物X2Y,下列说法不正确的是
| A.X可能位于ⅠA族 |
| B.两元素形成的化合物中,原子个数比不可能是1∶1 |
| C.X与Y的简单离子可能具有相同的电子层结构 |
| D.常温常压下,X2Y可能是气体、液体或固体 |
如图所示,大试管里充满某混合气体,置于光亮处,将滴管里的水挤入大试管后,烧杯中的水会进入大试管,大试管里的气体可能是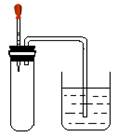
①N2、H2;②CO、O2; ③NO2、O2;④CH4、Cl2
| A.①或③ | B.②或④ | C.①或③或④ | D.③或④ |
下列判断中,错误的是
| A.加成反应:乙烯、苯由易到难 |
| B.氧化反应:乙醇、乙酸由易到难 |
| C.相对分子质量:葡萄糖、蔗糖由大到小 |
| D.沸点:正丁烷、异丁烷由高到低 |
下列现象或操作中一定涉及化学变化的是
| A.焰色反应 | B.丁达尔效应 | C.石油的分馏 | D.电解质溶液导电 |