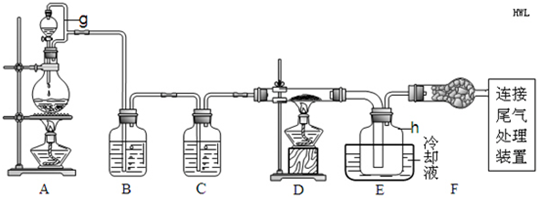
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

 相关信息如下:
相关信息如下: a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解; b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物; c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
| 熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
| 升华温度/℃ |
- |
- |
180 |
300 |
162 |
 请回答下列问题:
请回答下列问题: (1)写出装置A中发生反应的离子方程式 。
(1)写出装置A中发生反应的离子方程式 。 (2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却理由是 。 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
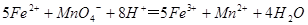
 ①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。
①滴定前是否要滴加指示剂? (填“是”或“否”),请说明理由 。 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 。
(10分,每空2分)水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到。
(2)将pH=8的NaOH溶液与pH=5的稀盐酸混合,并且保持100℃的恒温,欲使混合溶液pH=7,则NaOH与盐酸的体积比为。
(3)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是。
(4)室温时,Mg(OH)2(S) Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全 (指Mg2+的浓度等于10-5mol/L) 时,溶液的pH=_______。【已知25℃时Ksp[Mg(OH)2]=1.0×10-11】
Mg2+(aq)+2OH-(aq) 当Mg2+沉淀完全 (指Mg2+的浓度等于10-5mol/L) 时,溶液的pH=_______。【已知25℃时Ksp[Mg(OH)2]=1.0×10-11】
(10分每空2分)室温下,在一个容积为1L的密闭容器中,充入1molN2和3molH2,发生如下反应:N2+3H2 2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
(1)平衡时N2的物质的量为mol
(2)5min内用H2表示的反应速率为mol/(L.min)
(3)若向该1L密闭容器中再充入1molN2,则H2的转化率(填变大、变小或不变)
(4)写出N2和H2反应生成NH3的热化学反应方程式:
(5)写出该反应的平衡常数的表达式:
(本题共13分)药物M主要用于防治骨质疏松症和乳腺癌,其结构式为 (不考虑立体结构)。
(不考虑立体结构)。
M的新旧二条合成路线如下:
旧路线
新路线
已知:(1)半缩醛可水解:
(2)卤代烃(RX)与镁于室温下在干燥乙醚中反应,生成格氏试剂(RMgX):RX+Mg RMgX
RMgX
格氏试剂很活泼,能与许多物质发生反应。如:
完成下列填空:
(1)写出反应类型。(1) (2)
(2)写出结构简式。 A D
(3)旧法中的原料 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有种。
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有种。
任写其中一种的结构简式。
(4)写出B→C反应的化学方程式。
(5)设计一条以 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇 的合成路线(不超过5步反应)。
的合成路线(不超过5步反应)。
(本题共9分)乙烯在不同的条件下可被氧化生成不同产物。如下图所示:
已知:取0.62g A与过量的金属钠完全作用后,生成224mL(标准状况)气体。B的沸点低(10.7℃),B不能发生银镜反应而C能。D有酸性、强氧化性,可用于消毒杀菌。
完成下列填空:
(1)写出结构简式A D
(2)写出C发生银镜反应的化学方程式。
(3)在C的溶液中加入溴水实验现象:
解释产生该实验现象可能原因:
(4)D可以和乙烯反应产生B,写出该反应的化学方程式。
烟气的脱硫(除SO2)和脱硝(除NOx)都是环境科学研究的热点。可以通过氧化还原反应或酸碱反应进行脱硫和脱硝。完成下列填空:
(1)烟气中含有一定量的氮氧化物(NOx),可以利用甲烷与NOx一定条件下反应,产物为空气中含有的无害成分,从而消除污染。
写出CH4与NOx反应的化学方程式。
(2)用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO (g) N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。
N2(g)+2CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出下图。
前1s内平均反应速率v(N2)
第2s时的X值范围。
(3)为了除去烟气有害气体SO2并变废为宝,常用熟石灰的悬浊液洗涤废气,反应最终产物为石膏。而不采用澄清石灰水或熟石灰固体替代熟石灰悬浊液来吸收废气。
说明理由:
(4)用标准浓度的酸性KMnO4溶液可以测定空气中SO2含量。写出此测定方法的离子方程式。
(5)双碱法是一种低成本高效率的脱硫方法。先用第一碱作为吸收剂,与含SO2的烟气在吸收塔中接触发生反应,烟气中的SO2被吸收掉,然后脱硫废液在另一反应器中再与第二碱反应,使溶液得到再生,再生后的吸收液循环利用。
可用作第一碱。可用作第二碱。(选填编号)
a.NaOHb.Mg(OH)2c.石灰石d.石灰