(10分每空2分)室温下,在一个容积为1L的密闭容器中,充入1molN2和3molH2,发生如下反应:N2+3H2 2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
(1)平衡时N2的物质的量为 mol
(2)5min内用H2表示的反应速率为 mol/(L.min)
(3)若向该1L密闭容器中再充入1molN2,则H2的转化率 (填变大、变小或不变)
(4)写出N2和H2反应生成NH3的热化学反应方程式:
(5)写出该反应的平衡常数的表达式:
由石英制取硅胶,经历以下三步,试写出每步反应的化学方程式(是离子反应的,写出离子方程式)。
(1)用NaOH(aq)溶解石英:_______________________________。
(2)过滤,向滤液中加入盐酸,至沉淀不再产生:____________。
(3)微热,浓缩硅酸溶液;加热蒸干溶液,并使固体完全分解:_____________________;写出硅胶的一种用途:________________________________。
海战中为了掩蔽,常喷放SiCl4和液氨,而形成很浓的烟雾,若烟雾的成分是H2SiO3小颗粒和NH4Cl晶粒及水雾等,试写出生成它们的化学方程式。_________________________________________
氮化硅是一种高温陶瓷材料,结构类似于硅、二氧化硅,它的硬度大,熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应制得。
(1)根据性质,推测氮化硅的用途是()
| A.制汽轮机叶片 | B.制有色玻璃 |
| C.制永久性模具 | D.制造柴油机 |
(2)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式_______________________________________。
(3)用四氯化硅在氢气中与氮气反应(加强热)可制得较高纯度的氮化硅,反应的化学方程式为_____________________________________________________。
矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。此处的风化作用是说矿物与H2O和CO2同时作用的过程。案例如钾长石(KAlSi3O8)风化生成高岭土〔Al2Si2O5(OH)4〕,此反应的离子方程式是:2KAlSi3O8+11H2O+2CO2 2K++2
2K++2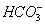 + 4H4SiO4+Al2Si2O5(OH)4,这个反应能发生的原因是_____________。Al2Si2O5(OH)4改写成氧化物的形式为__________________________。
+ 4H4SiO4+Al2Si2O5(OH)4,这个反应能发生的原因是_____________。Al2Si2O5(OH)4改写成氧化物的形式为__________________________。