海战中为了掩蔽,常喷放SiCl4和液氨,而形成很浓的烟雾,若烟雾的成分是H2SiO3小颗粒和NH4Cl晶粒及水雾等,试写出生成它们的化学方程式。_________________________________________
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)己知KBrO3在反应中得到电子,则该反应的还原剂是_____________。
(2)已知0.2mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,井标出电子转移的方向和数目: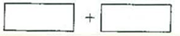
(4)溶液的酸碱性对氧化还原反应的方向有密切的关系。对于反应:AsO33-+I2+2OH- AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
现有A、B、C、D四种短周期元素,它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 |
相关结构和性质 |
| A |
其单质的一种晶体不是金属晶体,但是电的良导体,且难熔、质软并有润滑性,可用作原子核反应堆的慢化剂、火箭发动机喷灌和电极材料等。 |
| B |
其单质既能与强酸溶液反应,又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小。 |
| C |
是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多。 |
| D |
原子核外最外层电子排布式为nsnnp2n+1 |
(1)表中所述A的单质晶体中微粒间的相互作用有_____________、_____________。
(2)B元素的氧化物所对应的晶体属于____晶体(填“分子”、“原子”、“离子”、“金属”),工业上制备B元素单质的化学方程式:_______________________。
(3)钠与C元素形成的Na3C晶体中,C元素以C3-存在,C3-的电子排布式为_____________。C元素的气态氢化物溶于水后溶液呈碱性的原因(用方程式表示)_____________(填序号)。
(4)与D同主族的短周期元素,其单质及其化合物与D的单质及化合物均具有的性质为____(填序号)。
A.常温下单质跟水剧烈反应并放出氧气 B.气态氮化物具有很强的热稳定性
C.气态氢化物极易溶于水并呈强酸性 D.在HXO中X的化合价均为+l价
兔耳草醛是食品与化妆品工业中的香料添加剂。工业上可通过有机化工原料A制得,其合成路线如下图所示: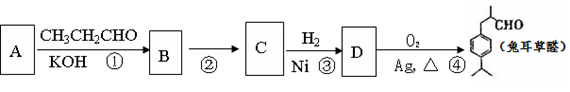
已知:① 2CH2=CH2+O2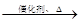 2CH3CHO
2CH3CHO
② CH3CHO+CH3CHO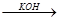 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
完成下列填空:
(1)A的结构简式是 ,B的结构简式是 。
(1)上述合成路线中属于加成反应的有(填写反应编号)。
(1)写出由D获得兔耳草醛的化学反应方程式。
(1)A的同分异构体中符合以下条件的有种。
a.能使FeC13(aq)显紫色
b.能发生加聚反应
c.苯环上只有两个互为对位的取代基
(1)简要写出证明C中含有碳碳双键的实验步骤。
衣康酸M是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件已略)。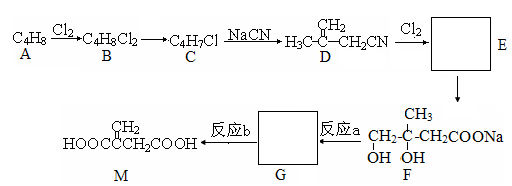
已知:(1)R-CH2-Cl + NaCN → R-CH2-CN + NaCl
(2)R-CH2-CN + NaOH + H2O → R-CH2-COONa + NH3
完成下列填空:
(1)A的结构简式是,M中官能团的名称是。
(2)如果反应a不完全,可能生成的杂质是(填写结构简式)。
(3)B→ C的化学方程式为。
(4)反应a与反应b的先后次序不能颠倒,解释原因:
。
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO) = ;该反应的平衡常数表达式为 。
(2)其它条件不变时仅增大压强,则。
a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是 。
a.c(N2 ) : c(CO) = 1:3 b.3v(N2 ) = v(CO)
c.固体质量不再改变 d.气体密度不再改变
达到平衡后改变某一条件,反应速率v与时间t的关系如图所示。
若不改变N2与CO的量,则图中t4时引起变化的原因可能是 ;图中t6时引起变化的原因可能是。
由图可知,平衡混合物中CO含量最高的时间段是。