由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
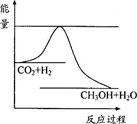
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; |
| C.△H<0,△S<0; | D.△H<0,△S>0。 |
(2)该图中能量的最高点和最低点之间的差值代表
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
① CH4(g)+H2O(g) ="=" CO(g)+3H2(g) △H=+206.0KJ/mol
② CO(g) + 2H2(g) ="=" CH3OH(g) △H=-129.0KJ/mol
CH4(g)和H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
把煤作为燃料可以通过下列两种途径:
途径I:C(s)+O2(g) CO2(g) ΔH=E1 ①
CO2(g) ΔH=E1 ①
途径II:先制水煤气:C(s)+H2O(g)===CO(g)+H2(g) ΔH=E2②
再燃烧水煤气:H2(g)+1/2O2(g) H2O(g) ΔH=E3③
H2O(g) ΔH=E3③
CO(g)+1/2O2(g) CO2(g) ΔH=E4④ ,试回答下列问题:
CO2(g) ΔH=E4④ ,试回答下列问题:
(1)判断两种途径放热:途径I放出的热量 _____(填“大于”、“等于”、“小于”)途径II放出的热量。
_____(填“大于”、“等于”、“小于”)途径II放出的热量。
(2)E1、E2、E3、E4的数学关系式 是_____________________________________。
是_____________________________________。
(3)由于制取水煤气反应里,反应物所具有的总能量_______(填“大于”、“等于”、“小于”)生成物所具有的总能量,正反应又是熵增加的反应,为了让该反应自发进行,要使反应条件为_______。
苯乙烯是一种重要的化工合成原料。现由苯乙烯合成聚三溴代苯乙烯和另外一种高聚物M的工艺如下:
已知:苯环上的取代反应有如下定位规律:当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对位或间位的氢原子。使新取代基进入它的邻、对位的取 代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
(1)D是高分子化合物,写出D的结构简式______________。
(2)①②③④⑤反应中属于取代反应的是________;
反应⑧的类型为________ 。
(3)设计反应①、③的目的是_______
(4)写出下列反应的化学方程式
反应③:________
反应⑦:________
(5)G有多种同分异构体,写出任意一个符合下列条件的同分异构体的结构简式________ 。
①能发生银镜反应;②能与FeCl3溶液发生显色反应;
③核磁共振谱氢图中出现6组吸收峰。
工业上合成氨的反应是:N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
N2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为________
②0~1小时内N2的平均反应速率________ mol·L-1·h-1;
③此条件下该反应的化学平衡常数K="" ________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________方向移动(填“正反应”或“逆反应”、“不移动”)。
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行右图实验(图中所用电极均为惰性电极): 
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
已知甲、乙、丙为常见的单质,A、B、C、D、X、Y、Z为常见化合物,且丙在常温常压下为气体,B为淡黄色固体,Y的摩尔质量数值比Z小16, B、X摩尔质量相同.各物质之间的转化关系如下图所示(各反应条件略).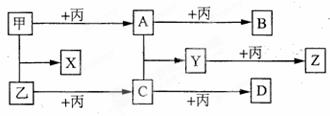
(1)乙位于周期表中_________ , 甲的最高价氧化物的水化物含有的化学键类型有_____________________.甲的氯化物晶体中的配位数是________
, 甲的最高价氧化物的水化物含有的化学键类型有_____________________.甲的氯化物晶体中的配位数是________
(2)将C通入溴水中,所发生反应的化学方程式是______;D属于_______晶体(填晶体类型).
(3)在101kPa时,4.0g乙在一定条件下与丙完全反应生成C,放出37kJ的热量,该反应的热 化学方程式是______________.
化学方程式是______________.
(4) 将B加入到Y的溶液中,其反应的离子方程式是_________________(产物仅限两种).
(5)比甲元素的原子序数少4的M元素,在一定条件下能与氢元素组成化合物MH5.已知MH5的结构与氯化铵相似,MH5与水作用有氢气生成,则MH5的电子式为_________(M要用元素符号表示).写出MH5与AlCl3溶液反应的化学方程式___________.