工业上合成氨的反应是:N2(g)+3H2(g)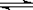 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
N2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为________
②0~1小时内N2的平均反应速率________ mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=" " ________ (保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
【已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39】
(5)该工艺流程中,可以循环利用的物质有 和 。
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 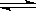 CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。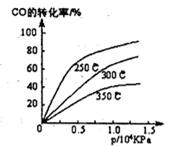
①该反应△H 0,△S 0(填“>”或“<”),则该反 自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是 。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.l" mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 (填序号)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
| D.重新平衡时n(H2)/n(CH3OH)增大 |
③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为 ,且欲使开始时该反应向逆反应方向进行,c的取值范围是 。
A、B、C、D、E五种短周期元素,F为第四周期过渡元素,核电荷数依次增加。
| 元素 |
有关性质及结构信息 |
|
| A |
A的一种原子内无中子 |
|
| B |
B原子的电子填充了4个原子轨道 |
|
| C |
C22—离子与电负性最大的元素的单质互为等电子体 |
|
| D |
D是短周期金属性最强的元素 |
|
| E |
C与E同族 |
|
| F |
外围电子排布式为nd2n(n+1)s(n-1) |
|
(1)E2-基态核外电子排布式,D单质的晶胞为体心立方,其配位数是,C的氢化物在同族元素中沸点反常,其原因是。
(2)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的的分子,乙的结构式是。已知1g乙完全燃烧热为46.16 kJ,乙燃烧热的热化学反应方程式是。
(3)甲是由A、B、C三种元素组成的相对分子质量最小的物质。甲的中心原子的杂化方式是。由甲中的两种元素组成,且与甲的电子数相等的物质的分子式是,该物质与C的单质在K2CO3溶液中形成燃料电池的负极反应式为。
(4)分别由A、C、D、E四种元素中的3种组成的两种物质丙和丁在溶液中反应生成气体和沉淀,该化学方程式是 。
(5)C与D形成一种物质戊,将过量戊加入过量F与稀硫酸反应后的溶液,得到红褐色沉淀和气体,发生反应的离子方程式是。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: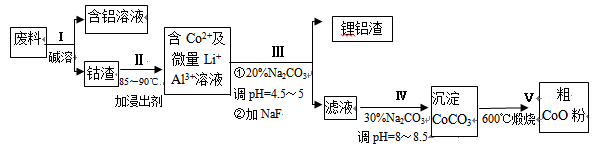
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式________________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是
____________________________________________________________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-) - c(H+)=c(HCO3-) + 2c(H2CO3) |
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-l)dn+6nsl,回答下列问题。
(1)该配位化合物的化学式为 。元素B、C、D的第一电离能由大到小的排列顺序为_______(用元素符号表示)。
(2)D元素原子的最外层电子排布图为 ,DC42-的立体构型为 。
(3)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。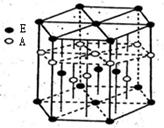
则该化合物的化学式为 ,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。