苯乙烯是一种重要的化工合成原料。现由苯乙烯合成聚三溴代苯乙烯和另外一种高聚物M的工艺如下:
已知:苯环上的取代反应有如下定位规律:当苯环上已经有了一个取代基时,新引进的取代基因受原取代基的影响而取代其邻、对位或间位的氢原子。使新取代基进入它的邻、对位的取 代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
代基有—R(烷基)、—NH2等;使新取代基进入间位的取代基有—COOH、—NO2等;
(1)D是高分子化合物,写出D的结构简式______________。
(2)①②③④⑤反应中属于取代反应的是________ ;
反应⑧的类型为________ 。
(3)设计反应①、③的目的是_______
(4)写出下列反应的化学方程式
反应③:________
反应⑦:________
(5)G有多种同分异构体,写出任意一个符合下列条件的同分异构体的结构简式________ 。
①能发生银镜反应; ②能与FeCl3溶液发生显色反应;
③核磁共振谱氢图中出现6组吸收峰。
填充下列表格
| 物质 |
粒子数(个) |
质量(g) |
物质的量(mol) |
摩尔质量(g/mol) |
| 氩气 |
0.2 |
|||
| S |
1.204×1023 |
|||
| CO2 |
22 |
|||
| C12H22O11 |
0.25 |
设NA表示阿伏加德罗常数的数值,其计算近似值为6.02×1023。按要求完成下列填空:
(1)1 mol Cl2中含有个氯气分子,约含有个氯原子。
(2)0.5 mol NH3中含有个氨分子,共约含有个原子。
(3)3 mol NO和mol NO2所含有的原子数相等。
(4)6mol H2O与mol NH3所含氢子数相等。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是 。
(6)1.204×1024个水分子的物质的量是。1molH2SO4中氧原子数为。
(7)1molMgCl2中氯离子数为,离子总数约为。
(8)1mol CuSO4·5H2O含有个Cu2+,含有_____mol水分子。
(9)2molCO(NH2)2中含mol碳原子,mol氧原子,mol氮原子,___mol氢原子。
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是。
(3)B分子的空间构型为形,该分子属于分子(填“极性”或“非极性”) 。
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式,该反应中反应物Cu的基态原子电子排布式为。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含个铜原子。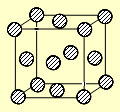
(5)D分子中心原子的杂化方式是,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为。
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。其中心原子采取杂化。
(3)写出化合物AC2的电子式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)E的外围电子排布式是,ECl3形成的配合物的化学式为,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是。
下图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。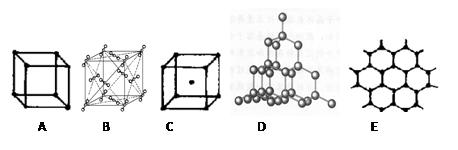
(1)代表金刚石的是(填编号字母,下同),金刚石中每个碳原子与个碳原子最接近且距离相等。金刚石属于晶体;
(2)代表石墨是,其中每个正六边形占有的碳原子数平均为个;
(3)代表干冰的是,它属于晶体,每个CO2分子与个CO2分子紧邻;
(4)上述B、C、D三种物质熔点由高到低的排列顺序为。