以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A |
元素B |
元素C |
元素X |
元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 |
基态原子M层p轨道上有5个电子 |
短周期中金属性最强,与X反应能生成两种常见化合物 |
最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
单质为双原子分子,结构中 键与 键与 数目比为1:2 数目比为1:2 |
根据上述信息回答下列问题:
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (填离子符号)。
(3)H−X与H−Y两种共价键中,键的极性较强的是 ,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是 (填元素符号);Y的常见氢化物易液化的主要原因是 。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是 。
下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: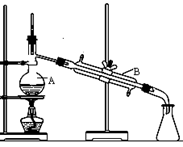

图1图2图3图4
(1)装置图1中A的名称是 。A 中一般要加入碎瓷片,其作用是 。若要从食盐溶液中得到食盐晶体,应选择的装置为 。
(2)为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(已知苯是一种有机溶剂,密度比水小,不溶于水)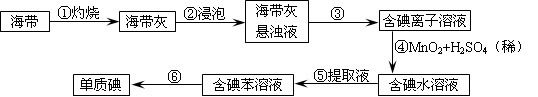
步骤③的实验选择上述装置图 (填图的序号)。步骤⑤的实验操作名称是 ,选择上述装置图 (填图的序号)。
将16.8g碳酸氢钠与11.7g过氧化钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,得到残余固体X。
(1)写出碳酸氢钠分解产生的气体分别与过氧化钠反应的化学反应方程式:
_________________、_________________________。
(2)残余固体X的成分是____________。
| A.Na2O2、NaOH | B.Na2O2、Na2CO3 | C.NaOH、Na2CO3 | D.Na2O2、NaOH、Na2CO3 |
(3)向固体X中逐滴加入1mol/L的稀盐酸至不再产生气泡为止,产生的气体在标准状况下的体积为____L。请以V(HCl)为横坐标,V(CO2)为纵坐标,画出产生CO2的体积和加入稀盐酸溶液体积的关系。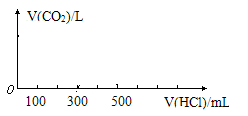
铁和铜是生活中两种常见的金属材料,某同学查阅资料得知铁主要是由铁矿石经热还原的方法冶炼的,常见的铁矿石有磁铁矿、赤铁矿、黄铁矿(主要成分为FeS2)等。
(1)赤铁矿的主要成分为__________(填化学式),工业上用一氧化碳还原赤铁矿冶炼铁的化学反应方程式为________________;
(2)从矿物资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4;(已知FeS2中Fe显+2价)
该反应中氧化剂是_____(填化学式),当有5molFeS2发生反应时,电子转移数为________;
(3)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,用FeCl3溶液作“腐蚀液”,请写出刻制过程的离子方程式__________________。
(1)某建筑材料,主要成分为铝硅酸盐,化学式是MgAl2H4Si4O14;化学式改写成氧化物形式为__________。
(2)除去镁粉中混有的铝粉(用离子方程式表示)________________________。
(3)Al(OH)3是胃舒平的主要成分,可用于治疗胃酸过多,用离子方程式表示其原理______________。
(4)向ag镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL,向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为n g.再将得到的沉淀灼烧至质量不再改变为止,得到固体p g.则下列关系不正确的是( )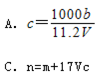
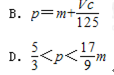
现有室温下浓度均为1×10-3 mol·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:
(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。
(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③____________⑥(填“>”“<”或“=”),溶液中的离子浓度由大到小的顺序为______________。
(3)将等体积的①、⑤混合,则溶液的pH________7(填“>”“<”或“=”),用离子方程式说明其原因: _________________________________。
(4)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为________________,最终产生H2总量的关系为________。
(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________③(填“>”“<”或“=”,下同)。
(6)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。