Ⅰ在催化剂作用下,CO2和H2可以制取甲醇。用工业废气中的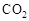 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
写出由二氧化碳和氢气制备甲醇的热化学方程式: 。
Ⅱ硼氢化钠(NaBH4)是有机合成中的重要还原剂。最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题: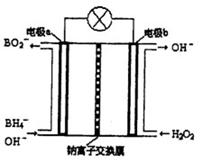
(1)电极b为 (填“正极”或“负极”),电极a上发生反应的电极反应式为 。
(2)电池工作时,Na+向 极(填“a”或“b”)移动,当左槽产生0.0125molBO2—离子时,右槽溶液pH=
(3)用该电池电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1molCu(OH)2,溶液恢复到电解之前状态,则电解过程中转移电子数目为_________
(6分)
25 ℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下题。
(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7。由此你能得到的结论是____________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00 mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11 mL。则b=________。
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是__________。
(8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。
写出下列反应的离子方程式。
(1)Na2CO3溶液与盐酸溶液混合:;
(2)硫酸铜溶液和氢氧化钡溶液混合;
(3)氯气与氢氧化钠溶液的反应;
(4)氯气与水的反应;
(5)CO2气体通入到澄清石灰水中;
①将一小块金属钠长期露置于空气中发生一系列变化,最终产物是;②用脱脂棉包住约0.2g过氧化钠粉未,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉燃烧起来。由实验现象所得出的有关过氧化钠和水反应的结论是:
a:有氧气生成;b。
Na2O2和水反应的化学方程式是。
0.1molAl2(SO4)3中含Al3+个, SO42-mol;同温同压下,等体积的CO和CO2所含分子数之比为。