现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中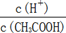 的比值将________(填“增大”、“减小”或“无法确定”)。
的比值将________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)________V(乙)。
利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)
①H2 ②Cl2 ③CH4 ④HCl ⑤NH3 ⑥NO ⑦H2S ⑧SO2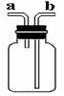
(1)若烧瓶是干燥的,则由b口进气收集的气体有(写序号);
(2)若烧瓶充满水,可收集的气体有(写序号)。
(3)若在烧瓶内装入浓硫酸使气体干燥,则可用此装置来干燥的气体有________,这时气体由________口进入。
高分子材料M在光聚合物和金属涂料方面有重要用途,已知
①磷酸的结构简式为
②M的结构简式为:
工业上合成M的过程可表示如下: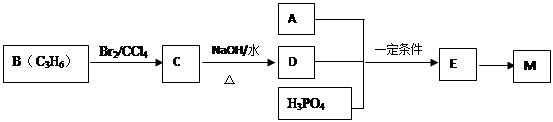
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是。
(2)下列说法正确的是 (填字母序号)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D易溶于水
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式(反应物均用结构简式表示):,该反应类型是反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。F存在下列转化关系:
写出F、N的结构简式F:,N: 。
写出反应①的化学方程式。
有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
| 实验步骤 |
实验结论 |
(1)A的质谱图如下: |
(1)证明A的相对分子质量为:__________。 |
| (2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 |
(2)证明A的分子式为: ________________。 |
| (3)另取两份9.0 g A分置于不同的试管中。 往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 |
(3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: |
(4)A的结构简式为: _________________________。 |
有关FeSO4的转化关系如下图所示(无关物质已略去)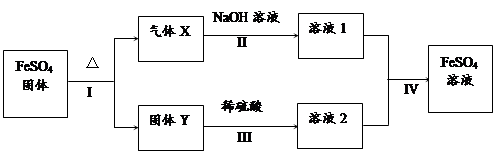
已知:①X由两种氧化物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。
(1)气体X的成分是 和(填化学式)。
(2)反应Ⅰ的反应类型属于(填序号)
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
溶液2中金属阳离子的检验方法是
已知反应Ⅳ发生了氧化还原反应生成了FeSO4,请写出相应的离子方程式:
茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
(1)写出反应①的化学方程式:_________________________________________________。(2)反应②的反应类型为:________________;反应③的反应类型为:________________。
(3)写出C中官能团的结构简式:___________________。
(4)上述①②③三个反应中,原子的理论利用率为100%、符合绿色化学要求的反应是___________(填序号)。
(5)乙酸苯甲酯有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中三个的结构简式是
请写出另外两个同分异构体的结构简式:____________________和__________________。