在一密闭容器中充入1 mol H2和1 mol I2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)ΔH<0。
(1)保持容器容积不变,向其中加入1 mol H2,反应速率加快吗? 理由是 。
(2)保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率也加快吗? 理由是 。
(3)保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应),反应速率 ,理由是 。
(4)保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率 ,理由是 。
(5)提高起始的反应温度,反应速率 ,理由是 。
下图是氮元素的几种价态与物质类别的对应关系:
回答下列问题:
(1)写出N2的一种用途。
(2)从N元素化合价分析,N2具有氧化性和还原性。各举一例说明(用化学方程式表示)
答:氧化性。
还原性。
(3)HNO3与上图中的物质C常用于检验Cl-的存在,则C的化学式为________。
(4)实验室制取物质B的化学方程式为。
(5)NO2与水反应生成物质A的化学方程式为。
(6)浓硝酸与木炭在加热条件下反应的化学方程式为。
现有溶质质量分数为98%、密度为1.84kg·L-1的浓硫酸,若用其配制1.0mol·L-1的稀硫酸250ml。回答下列问题:
(1)需要98%的浓硫酸ml(计算保留两位小数)。
(2)配制时,要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需。
铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)=mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案: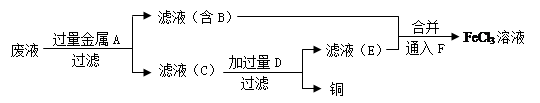
①滤渣C的化学式为。
②加过量D发生反应的离子方程式为。
③通入F发生反应的化学方程式为。
根据要求填空。
(1)下列物质中,属于电解质的是,属于非电解质的是。(填序号)
①碳酸氢钠②CO2③乙醇④铁
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为如下:
10 Al + 6 NaNO3 + 4 NaOH +18 H2O =" 10" NaAl(OH)4 + 3 N2↑
请用“单线桥法”表示上述反应中电子转移的方向和数目。
(3)已知氨气与氯气在常温条件下发生如下反应:8 NH3+3 Cl2= 6 NH4Cl +N2,该反应中还原剂与氧化剂的物质的量之比为。
(4)今有K2SO4和Al2(SO4)3混合溶液,已知其中c(K+)=" 0.2" mol·L-1,c(SO42-)= 0.7mol·L-1。则溶液中c(Al3+)=mol·L-1。
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
| KMnO4酸性溶液浓度 (mol·L-1) |
溶液褪色所需时间(min) |
|||
| 第一次 |
第二次 |
第三次 |
||
| 0.02 |
14 |
13 |
11 |
|
| 0.002 |
6.7 |
6.6 |
6.7 |
|
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
| KMnO4酸性溶液 |
H2C2O4溶液 |
||
| 浓度/ mol/L |
体积(ml) |
浓度/ mol/L |
体积(ml) |
| 0.02 |
2 |
b |
4 |
| a |
2 |
c |
4 |
则表中a=;b=;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH7,理由是。
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:。