铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式: 。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是 ;②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525g白色沉淀。则溶液中c(Cl-)= mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是 。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案: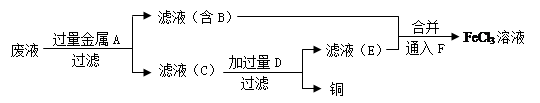
①滤渣C的化学式为 。
②加过量D发生反应的离子方程式为 。
③通入F发生反应的化学方程式为 。
(14分,方程式各3分,其余每空2分)2-羟基丁二酸存在于苹果中的一种有机物,它结构简式是: 。
。
(1)2-羟基丁二酸中含有的官能团名称是;在一定条件下它可发生化学反应的类型有(填序号);
| A.水解反应 | B.取代反应 | C.加成反应 | D.消去反应 E.加聚反应 F.中和反应 |
(2)下列物质与2-羟基丁二酸互为同分异构体的是(填序号);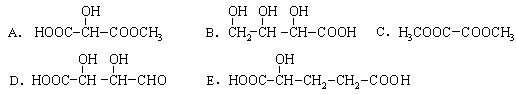
(3)写出2-羟基丁二酸与乙醇在一定条件下发生反应的化学方程式:
;
(4)2-羟基丁二酸在一定条件下可制得有机物X,X可使溴的四氯化碳溶液褪色。
写出X的结构简式 ,其化学方程式为:
(每空2分,16分)生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_________。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________ (不用写反应条件),原子利用率是_________。
(3)下列属于乙醇的同系物的是_____,属于乙醇的同分异构体的是_____。(选填编号)
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗__________mol氧气。
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_____________。
③下列说法正确的是__________。(选填字母)
| A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应 |
| B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车 |
| C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了 |
| D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯 |
㈠下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,请在下面的虚线框中用实线画出周期表的上边框,并画出金属与非金属的分界线。
㈡.(7分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
| A |
B |
||||||
| D |
E |
F |
|||||
| C |
G |
H |
(1)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为__________;实验室制取该化合物的化学方程式 _________________________
(2)元素G在元素周期表中的位置____________________
(3)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的________(填字母序号)元素组成的,用化学方程式表示吸收原理:
__________________。飞船中消耗1mol该化合物转移电子的物质的量为__________
(4)飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体的结构式为________。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②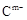 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④ A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)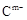 、
、 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)将E的单质通入A与D形成的化合物的水溶液中,在常温下反应的离子方程式为:
_____________________________________。
(4)常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液按体积比1:2混合,写出该反应的离子方程式。该溶液的溶质含有的化学键类型是
(5)在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为______________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。反应②也在水溶液中进行,其离子方程式是__________________________________,
用电子式表示化合物B的形成过程:_______________________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素
同周期,则反应①的化学方程式为___________________________________。
(3)同族非金属元素之间相互置换的一般是第ⅣA、第ⅥA、第ⅦA。