在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是
A正反应为吸热反应 L是气体
B正反应为放热反应 L是固体或液体
C正反应为吸热反应 L是固体
D正反应为放热反应 L是气体
【改编】某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43g。
下列说法中正确的是
| A.该溶液中一定不含Ba2+、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
【原创】取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol·L-1的NaOH溶液或0.10mol·L-1的稀氨水滴定得下图。下列说法正确的是
| A.由图可知曲线c为NaOH滴定硫酸 |
| B.由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 |
| C.曲线b、c的滴定实验可用酚酞做指示剂 |
| D.由图可知滴定前醋酸电离度约为1.67﹪ |
下列叙述正确的是
| A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应 |
| B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成 |
| C.图二装置中发生:Cu+2Fe3+ = Cu2++2Fe2+,X极是负极,Y极材料可以是铜 |
| D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+经过盐桥进入左侧烧杯中 |
【原创】下列说法不正确的是
| A.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液 |
| B.分子式为C6H12的某链状有机物,若6个碳原子在同一平面上,则与氢气加成后产物的名称为2,3-二甲基丁烷 |
C.已知某反应方程式为 ,生成物中带“※”号的C原子来自“ ,生成物中带“※”号的C原子来自“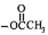 ”中的甲基 ”中的甲基 |
| D.硬脂酸甘油酯和油酸甘油酯互为同系物 |
【改编】X、Y、Z、W为短周期元素,原子半径X>Y>Z>W,X、Y、Z处于同一周期,Z、W处于同一主族,X、Y、Z原子序数之和为40,X是短周期中除稀有气体元素外半径最大的元素。下列说法正确的是
| A.若X、Y、W形成的化合物为XYW2,则其水溶液可以显碱性 |
| B.Y的最高价氧化物对应的水化物一定是碱 |
| C.稳定性:W的氢化物>Z的氢化物,沸点:Z的氢化物>W的氢化物 |
| D.X、Y的氧化物晶体类型一定相同 |