将化学知识系统化,有助于对化学问题的进一步认识和理解。
资料1:化学反应的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
资料2:化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
资料3:化学反应的能量变化(ΔH)与反应物和生成物的键能有关。在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。
根据以上资料回答下列问题:
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
__________________(选填“A”、“B”或“C”);
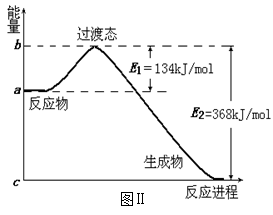
(2)图Ⅱ是1molNO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO
反应的热化学方程式:
___________________________________________;
(3) 下表是部分化学键的键能数据:

已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构(P4O10)如图Ⅲ所示,则上表中
X=_______________________________。
(4)图Ⅳ为氧族元素的氢化物a、b、c、d的生成热数据示意图。
请你归纳:非金属元素的氢化物的稳定性与氢化物的生成热(ΔH)
之间的关系:_____________________________________。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.工业设计生产NaClO2的主要流程如下: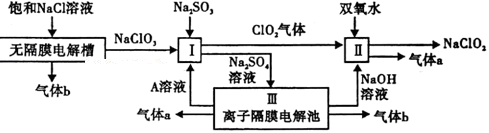
(1)A的化学式是 ,装置Ⅲ中A在 极区产生.
(2)Ⅱ中反应的离子方程式是
(3)通电电解前,检验Ⅲ中阴离子的方法和步骤是
(4)为防止Ⅱ中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是
(填字母编号).
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07×10-2 mol·L-1,Ⅱ中反应所得NaClO2
溶液(含少量NaOH)的pH=13,则溶液中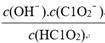 =
=
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200mL0.5mol·L-1的CuSO4溶液,生成铜3.2g,此时所得溶液中离子浓度由大到小的顺序是
氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l)ΔH2
则反应 4NH3(g)+3O2(g)=2N2(g)+6H2O(l)ΔH= 。(请用含有ΔH1、ΔH2的式子表示)
(2)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如下表所示:
| 温度/K |
平衡时NH3的物质的量/mol |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1 T2(填“>”、“<”或“=”)
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)= ,平衡时N2的转化率α(N2)= 。
③下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量(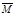 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间的关系,其中正确且能表明一段时间后该可逆反应达到了平衡状态的是 。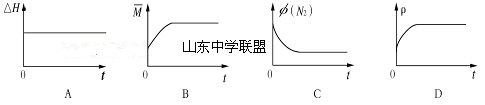
(3)某N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示。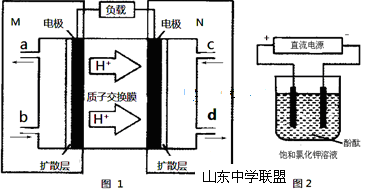
①M区发生的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和氯化钾溶液(电极均为惰性电极),设饱和氯化钾溶液体积为500mL,当溶液的pH值变为13时(在常温下测定),若该燃料电池的能量利用率为80%,则需消耗N2H4的质量为 g(假设溶液电解前后体积不变)。
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化: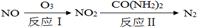
反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。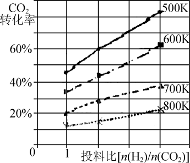
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
该反应平衡常数表达式为K= 。
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“大于”、“小于”或“等于”)0。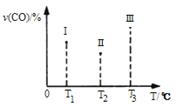
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g)△H1="a" kJ•mol﹣1
②2NO(g)+O2(g)⇌2NO2(g)△H2="b" kJ•mol﹣1
③CO(g)+1/2O2(g)⇌CO2(g)△H3="c" kJ•mol﹣1
④2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4 = kJ•mol﹣1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp= (用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是 (填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因 。
(5)探究反应④中平衡时CO2的体积分数与反应物中 的比值、温度的关系,得到如图2所示的曲线。
的比值、温度的关系,得到如图2所示的曲线。
①在X、Y、Z三点中,CO的转化率从大到小的顺序是 。
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线.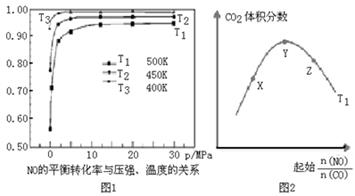
酸牛奶是人们喜爱的一种营养饮料,酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖,酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为:CH3CH(OH)COOH
工业上它可由乙烯来合成,方法如下:
CH2=CH2 A
A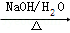 B
B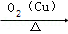 CH3CHO
CH3CHO C
C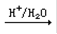 CH3CH(OH)COOH
CH3CH(OH)COOH
(提示:(1)CH3Cl+NaOH CH3OH+NaCl,
CH3OH+NaCl,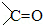 的加成类似于
的加成类似于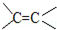 的加成)
的加成)
(1)乳酸所含的官能团的名称是 。
(2)写出下列转化的化学方程式:
①A的生成 。
②C的生成 。
③乳酸在一定条件合成聚乳酸 。
(3)写出符合下列要求的乳酸的所有同分异构体的结构简式 。
a、属于酯类 b、含有﹣OH c、能发生银镜反应.