只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液, 这种试剂是( )
| A.Ba(OH)2 | B.H2SO4 | C.NaOH | D.AgNO3 |
下列说法正确的是( )
| A.钢铁发生电化学腐蚀时,负极发生的反应是:Fe-3e-=Fe3+ |
| B.将钢铁与电源的正极相连,可防止其被腐蚀 |
| C.在镀件上镀铜时可用金属铜作阴极 |
| D.用电解法精炼粗铜时粗铜作阳极 |
光电池是发展性能源。一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl (s) Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl- (aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是( )
Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-=Cl- (aq),若将光源移除,电池会立即恢复至初始状态。下列说法不正确的是( )
| A.光照时,电流由X流向Y |
| B.光照时,Pt电极发生的反应为:2Cl- +2e-=Cl2↑ |
| C.光照时,Cl-向Pt电极移动 |
D.光照时,电池总反应为:AgCl (s) +Cu+ (aq) Ag (s) +Cu2+ (aq)+Cl-(aq) Ag (s) +Cu2+ (aq)+Cl-(aq) |
下列各装置中,在铜电极上不能产生气泡的是( )
下列叙述中不正确的是( )
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.原电池的正极上发生氧化反应,负极上发生还原反应 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.用原电池做电源进行电解时,电子从原电池负极流向电解池阴极 |
下列离子方程式书写不正确的是( )
A.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+)=7∶2时, 2Al3++7OH-=Al(OH)3↓+  |
| B.Cl2与FeBr2溶液反应,当n(Cl2)∶n(FeBr2)=1∶1时,2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C.Ca(OH)2溶液与NaHCO3溶液反应,当 n[Ca(OH)2]∶n(NaHCO3)=1∶2时, 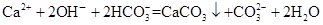 |
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3)=1∶2时, |