向某溶液中加入BaCl2溶液,再加入稀HNO3至溶液呈中性,有白色沉淀产生。该溶液可能含有
| A.CO32— | B.OH— | C.SO42— | D.HCO3— |
已知H2(g)+Br2(l)=2HBr(g)ΔH=-72kJ·mol-1,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) |
Br2(g) |
HBr(g) |
|
| 1mol分子中的化学键断裂时需要吸收的能量/kJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200
下列叙述正确的是
| A.熵变小于零而焓变大于零的反应肯定不能发生 |
| B.热化学方程式中ΔH的值与反应物的用量有关 |
| C.化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 |
| D.用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |
下列说法正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.核能、太阳能、生物质能、风能、氢能均属于新能源 |
| C.自发反应的熵一定增大,非自发反应的熵一定减小 |
D.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0 2CO(g)不能自发进行,则该反应的ΔH>0 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是 ( )
| A.反应开始到10s,用Z表示的反应速率0.158mol/(L·s) |
| B.反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C.反应开始到10s时,Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+Y(g)  Z(g) Z(g) |
1g H2燃烧生成液态水放出142.9 kJ的热量,下列热化学方程式书写正确的是( )
| A.2H2(g)+ O 2(g) = 2H2O (1), ΔH = —142.9 kJ·mol-1 |
| B.2H2(g)+ O 2(g) = 2H2O (1), ΔH = —571.6 kJ·mol-1 |
| C.2H2+O2 = 2H2O, ΔH = —571.6 kJ·mol-1 |
D.H2(g)+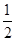 O 2(g) = H2O (1), ΔH = +285.8 kJ·mol-1 O 2(g) = H2O (1), ΔH = +285.8 kJ·mol-1 |