在下述条件下,一定能大量共存的离子组是
| A.强酸性溶液中:Al3+、K+、Mg2+、Cl-、SO42- |
| B.PH=13的溶液中:Cl-,HCO3-,NO3-,NH4+ |
| C.c(Fe3+)="0.1" mol·L-1的溶液中:Na+、SCN—、Cl-、Br- |
| D.强碱性溶液中:ClO-、SO42-、SO32-、Na+ |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O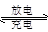 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是()
| A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2 |
B.放电时正极反应为:2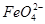 +6e-+8H2O====2Fe(OH)3+10OH- +6e-+8H2O====2Fe(OH)3+10OH- |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 |
| D.放电时正极附近溶液的碱性增强 |
当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
| A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 |
| B.电池的正极反应式为:O2十4H+十4e-==2H2O |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
在pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
如图所示,电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下表中说法正确的是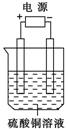
| 电极材料 |
通电后的变化 |
||
| 阴极 |
阳极 |
||
| A |
石墨 |
石墨 |
阴极质量增加,溶液的pH增大 |
| B |
铜 |
铜 |
阳极质量减小,阴极质量增加 |
| C |
铁 |
铁 |
两极的质量不发生变化 |
| D |
铂 |
铁 |
阴极质量增加,溶液的浓度不变 |
下列叙述正确的是
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |