可逆反应mA(s)+nB(g)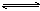 pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是
pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是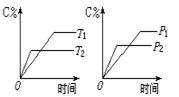
| A.到达平衡后,若使用催化剂,C的质量分数增大 |
| B.平衡后,若升高温度,平衡则向逆反应方向移动 |
| C.平衡后,增大A的量,有利于平衡向正反应方向移动 |
| D.化学方程式中一定n>p+q |
下列关于水在人体中的作用错误的是
| A.提供能量 |
| B.做营养物质水解的反应物 |
| C.做溶剂 |
| D.调节体温 |
微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用。下列元素不是微量元素的是
| A.I | B.H | C.Zn | D.Fe |
将某病人的尿液加入新制的Cu(OH)2浊液中,微热时如果观察到红色沉淀,说明该尿液中含有
| A.醋酸 | B.葡萄糖 | C.食盐 | D.酒精 |
在下列物质:①K2SO4 ,②HCHO,③MgSO4 ,④NH4Cl,⑤KOH,⑥Hg(NO3)2中,能使蛋白质变性的是
| A.②④⑥ | B.①③⑤ | C.②③⑥ | D.②⑤⑥ |
为了鉴别某白色纺织品的成分是真蚕丝还是“人造丝”,可选用的方法是
| A.滴加浓盐酸 | B.滴加浓硫酸 |
| C.滴加酒精 | D.灼烧 |