红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据),根据下图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1 (填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= 。
右图是实验室制取溴苯的装置图
(1)三颈瓶内苯参加反应的化学方程式是。
(2)锥形瓶中导管出口附近出现的现象是,
导管口不能插入锥形瓶中的液面之下,其目的是。
(3)采用冷凝管的作用是,干燥管的作用是。
(4)反应结束向三颈瓶中加入氢氧化钠溶液,作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入溶液,若(填现象),则能证明。
按题给要求填空:
(1)写出以乙炔为原料制备聚氯乙烯反应方程式(无机物不限)
①。②。
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_______,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_________________________。
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3。其核磁共振谱中给出的峰值(信号)有两个,如下图(一)所示:
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是。
| A.CH3CH3 | B.CH3COOH | C.CH3COOCH3 | D.CH3C(CH3)3 |
(2)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如上图(二)所示,则A的结构简式为:,请预测B的核磁共振氢谱上有 个峰(信号), 强度比为。
(3)用核磁共振氢谱的方法来研究C2H6O的结构。若核磁共振氢谱上只有一个峰,则C2H6O的结构简式是,若核磁共振氢谱上有三个峰,则C2H6O的键线式是。
按要求填空:
(1)用系统命名法命名下列物质
(2)写出下列有机物的结构简式:
2-甲基-1-戊烯
(3)写出下列有机物的键线式:
(4)写出下列物质的分子式: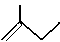
按要求填空。
I.下列各组中的两种有机物,可能是:(A)相同的物质,(B)同系物,(C)同分异构体。请判断它们之间的关系(用A、B、C填空)
① 2-甲基丁烷和丁烷, ②正戊烷和2,2-二甲基丙烷_____________,
③对二甲苯和1,4—二甲苯____________ , ④ 1-已烯和环已烷________________。
II.按官能团的不同,可以对有机物进行分类,将符合要求的答案填在横线上。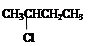 ① CH3CH2CH2COOH②
① CH3CH2CH2COOH②  ③
③
④  ⑤
⑤  ⑥
⑥ 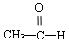
(1)芳香烃:;(2)卤代烃:;(3)酚:;
(4)醛:;(5)羧酸:;(6)酯:。