为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。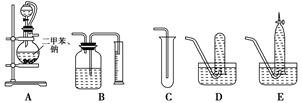
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如右图转化关系。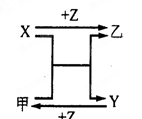
回答下列问题:
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的非极性气态分子, Y原子的基态轨道表示式为,乙的电子式为。
(2) 若X基态原子外围电子排布式为3s1,Y具有许多优越的性能,被称为未来金属,甲中共含有90个电子,则其分子式为,Y的电子排布式为。
(3) 若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为:,Y原子基态电子排布式为。
用VSEPR模型和杂化轨道理论相关知识填表:
| 分子或离子 |
孤对电子对数 |
VSEPR模型名称 |
中心原子杂化轨道类型 |
分子或离子的立体构型名称 |
| CH4 |
0 |
正四面体形 |
sp3 |
正四面体形 |
| BeCl2 |
||||
| SO2 |
||||
| CH3+ |
||||
| SO42- |
||||
| NCl3 |
(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=__________。
(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=__________。
(3)某温度(t℃)时,水的KW=10-13,则该温度______25℃(填大于、等于或小于),理由是_________________________________________________;将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,①若所得混合溶液为中性,则a :b =_________;
②若所得混合溶液pH=2,则a :b =__________。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。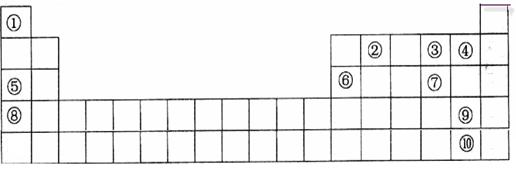
用化学符号回答下列问题:
(1)表中最活泼的金属与最活泼的非金属形成的物质是;
(2)⑤、⑥、⑧的最高价水化物的碱性由强到弱的顺序是;
③、④、⑦氢化物稳定性由强到弱的顺序是;
(3)③与⑤按原子个数1:1所成的化合物的电子式为________________;该化合物与水反应的离子方程式为________________。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物反应的离子方程式为;
(5)请设计一个实验方案,比较⑨、⑩的单质氧化性的强弱:。
下列五种物质中① Ar② H2O2③ NH4 NO3④ KOH⑤ Na2O2⑥ CaCl2只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。(填写序号)