物质是一种不饱和烃,它广泛存在于自然界中,也是重要的有机合成中间体之一。某化学实验小组从A经反应①到⑤完成了环醚的合成工作:

该小组经过上述反应,最终除得到 外,还得到它的同分异构体,
外,还得到它的同分异构体,
其中分别代表一种或多种物质。已知:

请完成:
(1)写出由制备环醚的合成路线中的结构简式:。
(2)①写出的一种结构简式:
②写出由该出发经过上述反应得到的的同分异构体的结构简式:。
(3)该小组完成由到的合成工作中,最多可得到种环醚化合物。
香兰素( )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:
(1)写出A的结构简式,1 mol A完全反应消耗O2的物质的量为mol。
(2)写出反应②的化学方程式_______________________________。
(3)反应③的反应类型是_____,1 mol香兰素在一定条件下与H2发生反应,最多消耗H2_________mol。
(4)D与香兰素互为同分异构体,能与NaHCO3溶液反应放出气体,遇FeCl3溶液显紫色,且苯环上的一氯取代物只有2种,请写出D的结构简式______。
(5)香兰素的另一种同分异构体结构简式为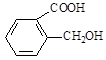 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_________。
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_________。
(11分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)检验SO42-已经沉淀完全的操作是:。
(2)在粗盐经过溶解→过滤后的溶液中最后滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是。
(3)将经过操作(2)后的溶液过滤,滤液中含NaOH和Na2CO3两种杂质,写出除去这两种杂质的化学方程式、。
(1)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ/mol, 则表示肼跟N2O4反应的热化学方程式
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g)ΔH=-90.7 kJ·mol-1
CH3OH(g)ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
______________________________________________________________________。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol•L-1。反应进行2min
后A的浓度为0.8 mol•L-1,B的浓度为0.6 mol•L-1,C的浓度为0.6 mol•L-1。则2min内反应的平
均速率υ(A)=____________, υ(B)=_________________,υ(C)=_______________。该反应的化学
反应方程式为:_____________________________。
依据事实,写出下列反应的热化学方程式
① 2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量
______________________________________________________________
② 1克甲烷完全燃烧生成二氧化碳和液态水放出了aKJ的热,写出甲烷燃烧热的热化学方程式:
_____________________________________________________________
③ 12g镁在氧气中完全燃烧,生成氧化镁固体,放出247KJ的热量