将某一元酸HA与NaOH等体积混合,请根据题目要求回答下列问题:
(1)若c(HA)=c(NaOH)=O.lmol/L,测得混合后溶液的pH>7。
①HA是弱电解质,能证明HA是弱电解质的方法是( )。
A测得0. Imol/L HA的pH>l B.测得NaA溶液的pH>7
C.pH=l的HA与盐酸,稀释10倍后,盐酸的pH变化大
D.用足量的锌分别与相同pH、相同体积的盐酸和HA反应,产生氢气一样多
②混合溶液中,关系式一定正确的是( )。
A.c(A-)>c(Na+)c(OH-)>c(H+) B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L D.C( HA) +c( H+)= c(OH-)
③若HA(足量)+B2一 A一+HB-;H2B(少量)+2C- B2-+2HC: HA+C- A-十HC
则相同pH的①NaA②Na2B③NaHB④NaC的四种溶液,各物质的物质的量浓度从大到小的顺序为
(填序号)。
(2)若c( HA)==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA稀释10倍后溶液的pH与该浓度的HA和0.1 mol/L NaOH等体积混合后溶液的pH相等,则HA溶液的浓度为 。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏低的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。
(1)工业上正在研究利用CO2来生产甲醇燃料的方法。
已知:H2(g)+1/2O2(g)===H2O(g)ΔH1=-242 kJ/mol
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(g) ΔH2=-676 kJ/mol
①写出CO2和H2反应生成气态甲醇等产物的热化学方程式:___________________。
②下面表示合成甲醇的反应的能量变化示意图,其中正确的是________(填字母序号)。
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:
①该电池外电路电子的流动方向为________(填写“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的酸性与工作前相比将________(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应式为________。
向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:
xA(g)+yB(g) pC(g)+qD(g)
pC(g)+qD(g)
已知:平均反应速率v(C)=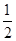 v(A);反应2 min时,A的浓度减少了
v(A);反应2 min时,A的浓度减少了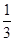 ,B的物质的量减少了
,B的物质的量减少了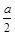 mol,有a mol D生成。回答下列问题:
mol,有a mol D生成。回答下列问题:
(1)反应2 min内,v(A)=________。
(2)化学方程式中,x=________、y=________、p=________、q=________。
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)反应达平衡时的压强与起始时的压强比。
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:反应速率________(填“增大”、“减小”或“不变”),理由是_________________;
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式。
(2) 化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)用电子式表示化合物D2C的形成过程。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;负极反应:________________________;
(10分)如图是依据各种元素(原子)的性质与原子序数(1~20)的关系而作出的,各图的纵轴可能代表下列某一性质:核电荷数、中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素。(注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、18的元素在纵轴上没有对应的数值)
请回答下列问题:
(1)图2纵轴代表的性质是,图4纵轴代表的性质是。
(2)A元素的其最低负化合价为。
(3)B、C两种元素形成的化合物中,C显最高正化合价而B显最低负化合价,该化合物的化学式为。
(4)1~20号元素中,原子半径最大的是(稀有气体除外)。
按要求回答以下问题:
(1)X、Y、Z 是短周期非金属元素,核电荷数依次增大。X原子外围电子排布为ns2np2,Z是地壳中含量最多的元素。W、Q是第四周期元素,其中Q元素的核电荷数为29。W原子核外未成对电子数在同周期中最多。
①Y元素在周期表中的位置为______________ ;其轨道表示式为_________________。
②X、Y、Z元素的第一电离能由大到小的顺序为_________________(用元素符号作答),X与Z形成三原子分子的电子式为___________(用相关的化学用语作答)。
③Y的氢化物沸点_______Z的氢化物的沸点(填“ >”“<”或 “=”)。
④基态W原子的外围电子排布式为。
⑤Q的氢化物的晶胞结构如图所示,其化学式是。
(2)过渡元素在生活、生产和科技等方面有广泛的用途。
①应用于合成氨反应的催化剂(铁)的表面上存在氮原子,上图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为________。
②现代污水处理工艺中常利用聚合铁{简称PFS,化学式为[Fe2(OH)n(SO4)3-n/2]m,n<5,m<10}在水体中形成絮状物,以吸附重金属离子。下列说法中不正确的是______。(填序号)
| 元素 |
Mn |
Fe |
| 电离能 |
||
| (kJ·mol-1) |
||
| I1 |
717 |
759 |
| I2 |
1 509 |
1561 |
| I3 |
3 248 |
2 957 |
A.PFS中铁显+3价
B.铁原子的价电子排布式是3d64s2
C.由FeSO4溶液制PFS需经过氧化、水解和聚合的过程
D.由上表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
③铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。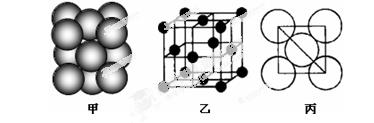
晶胞中铂(Pt)原子的配位数数为为。