某同学设计如图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题: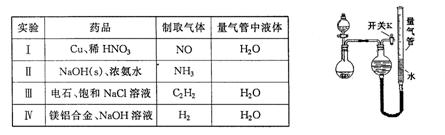
(1)实验过程中,使用分液漏斗滴加液体的操作是 。
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行? (填“可行”或“不可行”),原因是 。
(3)实验Ⅲ烧瓶中发生反应的化学方程式是 ,打开开关K,产生的气体经验纯后点燃,现象是 。
(4)实验Ⅱ中量气管中的液体最好是____(填字母编号,下同)
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理。以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有 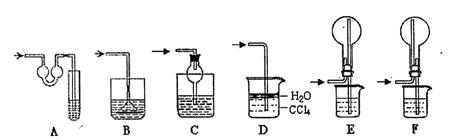
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② ,③视线与凹液面最低处相平。
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 |
镁铝合金度量 |
量气管第一次读数 |
量气管第二次读数 |
| ① |
1.0g |
10.0mL |
346.3mL |
| ② |
1.0g |
10 .0mL .0mL |
335.0mL |
| ③ |
1.0g |
10.0mL |
345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为____ 。
某兴趣小组同学共同设计了如图所示的实验装置。该装置既可用于制取气体,又可用于验证物质的性质。
⑴打开K1关闭K2,可制取某些气体。
甲同学认为装置I可用于制取H2、NH3、O2,但装置II只能收集H2、NH3,不能收集O2。其理由是。
乙同学认为在不改动装置II仪器的前提下,对装置II进行适当改进,也可收集O2。你认为他的改进方法是。
⑵打开K2关闭K1,能比较一些物质的性质。
丙同学设计实验比较氧化性:KMnO4>Cl2>Br2。在A中加浓盐酸后一段时间,观察到C中的现象是;仪器D在该装置中的作用是。
丁同学用石灰石、醋酸、苯酚钠等药品设计了另一实验。他的实验目的是。
(16分)二氧化钛是一种不溶于稀酸的物质,常用于制取金属钛。某种金红石矿石的主要成分是TiO2,含有Fe2O3和Al2O3杂质。一研究性学习小组设计如下方案制备金属钛,并得到其它副产品。
(1)已知Fe(OH)3、Al(OH)3,开始沉淀的pH数据(见下表)
| 氢氧化物 |
Fe(OH)3 |
A1(OH)3 |
| 开始沉淀pH |
1.5 |
3.3 |
向溶液I中滴加NaOH溶液,并调溶液pH,若开始只得到一种沉淀,该沉淀是
,应控制pH的范围是,反应的离子方程式是;
(2)向溶液Ⅱ中“继续加适量NaOH溶液”,若操作不当会减少滤渣Ⅲ的质量,请你设计另一种方案代替向溶液Ⅱ中“继续加适量NaOH溶液”的方案,该方案是,反应的离子方程式是;
(3)已知:①CO2(g)==C(s)+O2(g);△H="393.5" kJ·mol-l
②CO(g)+ O2(g)==CO2(g);△H=-283 kJ·mol-l
③TiO2(s)+2Cl2(g)==TiCl4(s)+O2(g);△H ="141" kJ·mol-l
写出TiO2与Cl2+C反应的热化学方程式。
(4)若经过多步反应后制得b g金属钛,则金红石矿石中TiO2的质量分数为
某化学兴趣小组需制备22.4 LSO2气体(标准状况),他们依据化学方程式Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓硫酸(ρ=1.84 g/cm3)110mL充分反应,待锌粒全部溶解后,收集所得气体X。经测定其中含有气体杂质。
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是(填分子式)。产生这种结果的主要原因是(用离子方程式表示)。
(2)为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体(X)取样进行认真探究。
①组装好仪器后,盛放药品前,必要的一个操作是。
②A中加入的试剂可能是,作用是。
B中加入的试剂可能是,作用是。
③证实气体X中混有较多杂质气体,应观察到C中的实验现象是,D中最好选择的试剂是。
(3)假定气体在吸收过程吸收完全,对上述装置略加改进,可以粗略测定X气体中SO2的体积分数。改进时可选用的下列仪器为(填代号)。
a.导管 b.水槽 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
TiO2 +2C+2Cl2 TiCl4 +2CO ;TiCl4 +2Mg
TiCl4 +2CO ;TiCl4 +2Mg  Ti + 2MgCl2
Ti + 2MgCl2
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先从侧管中通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
⑴正确的操作顺序为(填序号)___________________________ 。
⑵装置A中反应的离子方程式为__________________________________ 。
⑶装置D中冷凝管进水口的位置是(填a或b)___ 。
⑷ TiCl4露置于空气中极易水解,其化学方程式可表示为_____________________ 。
⑸工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,氩气的作用为__ 。
实验探究题
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题: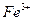 、
、 谁的氧化性更强?
谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性: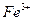 >
> ,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
②乙同学认为氧化性: >
> 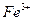 ,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 |
实验现象 |
|
| 方案1 |
||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为_▲_。
②在100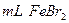 溶液中通入
溶液中通入 (标准状况),溶液中有1/3的Br-被氧化成单质
(标准状况),溶液中有1/3的Br-被氧化成单质 ,则原
,则原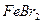 溶液中
溶液中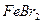 的物质的量浓度为_▲_。
的物质的量浓度为_▲_。