某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。直到____________ _ 。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。

| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
1.56 |
28.08 |
26.52 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下: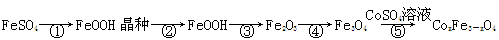
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是,吹入空气的作用为。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Co2+ |
6.9 |
9.4 |
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
②。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: 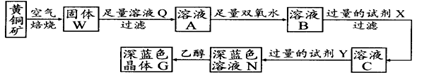
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表: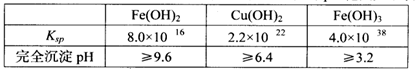
(1)黄铜矿在空气中焙烧能生成铁和铜的低价硫化物,写出其反应的化学方程式:;
(2)试剂X的化学式为;
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为,用pH试纸测该溶液pH值的方法是;
(4)在溶液N中加入乙醇的目的是。
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题: 

I II
(1)写出上述图中仪器的名称:①;②;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为;实验时仪器②中冷却水的进口为(选填“ f ” 或 “g ” )。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是,。
(4)下列操作,使所配溶液浓度偏小的是(填序号)。
①烧杯中NaOH溶液移入容量瓶后没有洗涤烧杯
②定容后摇匀,发现液面低于刻度线,再滴加蒸馏水至刻度线
③实验用的容量瓶洗净后未干燥,里面含有少量水
④定容时俯视
某学生用实验室常见的酸、碱、盐和金属单质为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的装置。试回答:
(1)若试管中装有铜丝网隔板,利用该装置可制取哪些气体?
(写出两种)。
(2)若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体?
。
该反应的离子方程式是:。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程。其设计的模拟装置如下: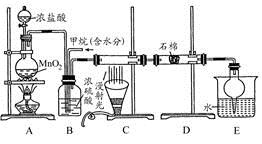
根据要求填空:
(1)B装置有三种功能:①均匀混合气体;②;③。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应。
(3)D装置的石棉中均匀混有KI粉末,其作用是。
(4)E装置的作用是(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为(填分离方法名称)。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为(填编号)。
A.CH4 B.CH3C1C.CH2C12 D.CHCl3E.CCl4