硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有的CO2,应选择的试剂有 。
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.澄清石灰水 | D.盐酸 |
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是
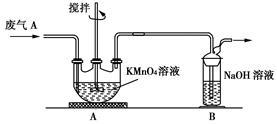
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4•7H2O)。实验模拟制备皓矾工业流程如下:
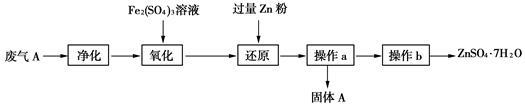
①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、过滤、洗涤、干燥。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。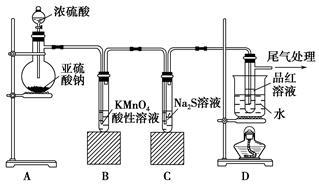
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________
(2)实验过程中,装置B、C中发生的现象分别是________________、________________,这些现象分别说明SO2具有的性质是____________和____________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________
(4)尾气可采用__________溶液吸收。
某研究性学习小组同学设计了如下图制取氯气(药品:MnO2和浓盐酸)并验证其性质的实验装置。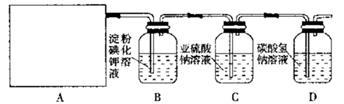
请回答下列问题:(1)该实验中A部分的装置是 (填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是 ;
整套实验装置存在的明显缺陷是 。
(3)写出D装置中发生反应的离子方程式: 。
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的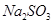 已被氧化(简述实验步骤): 。
已被氧化(简述实验步骤): 。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图实验装置回答问题
(1)写出下列仪器的名称:① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的是 (填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 ,将仪器补充完整后进行的实验操作的名称为 ;②的进水口是 (填“f”或“g”)。
(4)现需配制250 mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误之处:① ;② 。
草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
【实验1】甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L
H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
KMnO4溶液 /ml |
H2C2O4溶液 /ml |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| Ⅰ |
8.00 |
5.00 |
3.00 |
20 |
|
| Ⅱ |
8.00 |
5.00 |
3.00 |
30 |
|
| Ⅲ |
8.00 |
5.00 |
1.00 |
20 |
2.00 mL 蒸馏水 |
(1)如果研究温度对化学反应速率的影响,可用实验_________ 和________ 作对比(用Ⅰ~III表示)。
(2)对比实验Ⅰ和III,可以研究__________对化学反应速率的影响,实验Ⅲ中加入2.00 mL蒸馏水的目的是________________。
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是 的影响。
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 (填字母)。A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰
甲、乙两同学欲制取纯净的Fe(OH)2 ,根据右图所示的装置进行试验。A管中是Fe和稀硫酸, B管中是NaOH溶液,回答下列问题。
(1)同学甲:先夹紧止水夹a,使A管开始反应,一段时间后在B管中观察到的现象是:①液面上升,② 。此时B中发生现象②的化学反应方程式是: 。
(2)同学乙:先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹a。同学乙在开始阶段进行的操作,主要的实验目的是: 。
(3)你认为 (填甲或乙)同学的实验可制取纯净的Fe(OH)2。