复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3 COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2H ClO ClO |
| B.CO2+H2O +NaClO = NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2 Na2CO3+2 C6H5OH C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是 (填编号),其pH值为_______(填数值);pH最大的是 (填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:
。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是 ,反应的离子方程式为 。
废钒催化剂的主要成分是V2O5、VOSO4、K2SO4、SiO2和Fe2O3等,现欲利用以下工艺流程回收V2O5。
回答下列问题:
(1) VOSO4中,V元素的化合价为_______,①中产生的废渣的主要成分是_________。
(2)配平④中反应的离子方程式:
(3)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表:
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为______________。
(4)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺流程中,可循环利用的物质还有________________。
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:______________________________________。
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)铝的原子结构示意图为___________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是__________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:_________________。
(3)如图装置中,铁作________极,铜电极的电极反应式为_________________________。
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:__________________________________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:_____________________________ ,该反应的氧化剂是_________________。
(6)某校兴趣小组为测定一种铁铝硅合金 (FexAlySiz) 粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸溶液,充分反应后过滤,测定剩余固体质量0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧,得红棕色粉末1.60g,通过计算确定此合金的组成为________________ (填化学式)。
利用太阳能分解水生成的氢气,在催化剂作用下氢气与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10 mol水消耗的能量是kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为。
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):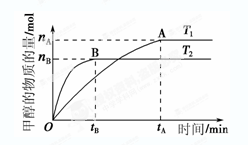
①可逆反应的平衡常数表达式K=
②下列说法正确的是
| A.温度为T1时,从反应开始到平衡,生成甲醇 的平均速率为v(CH3OH)=  mol·L-1·min-1 mol·L-1·min-1 |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.该反应为放热反应 |
D.处于A点的反应体系从T1变到T2,达到平衡时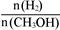 增大 增大 |
③在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为;
(4) 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为
2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为;
负极的反应式为。[来
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 |
电离平衡常数(25℃) |
| NH3·H2O |
Kb=1.77×10-5 |
| HCN |
Ka=4.93×10-10 |
| CH3COOH |
Ka=1.76×10-5 |
| H2CO3 |
Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。