碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠俗称 ,其水溶液显 性(填“酸”、“碱”或“中”)。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者(填>、<或=)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为 。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为 。
(本题16分)硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢。(皓矾为ZnSO4?7H2O)
(1)上述流程中共有7个化学反应,其中有____________个属于氧化还原反应。
(2)写出过氧化氢和物质C的电子式:____________________,_______________。
(3)写出F、G的化学式: F_____________、G_________________。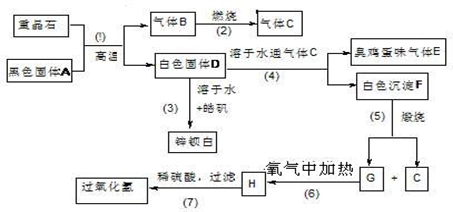
(4)写出下列化学反应方程式:
反应③__________________________________________________________。
反应⑦____________________________________________________。
(5)取锌钡白固体16.5g溶于100mL 1mol/L的H2SO4溶液中,放出H2S 气体1008mL(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为________mol/L
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,应加入 1 mol/L的NaOH溶液_____mL
(本题14分)a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如图所示。a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种。化合物甲、乙、丙、丁、戊之间也能相互反应。已知乙、戊分别是由a、b两元素按原子个数1∶1和2∶1组成的化合物。若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)
①b+c→丁②a+c→丙③乙+丁→甲④丙+丁→c+戊
试解答下列问题:
(1)写出下列物质的化学式:甲:丙:丁:
(2)写出反应③的化学方程式::
(3)戊的结构式是;实验测得化合物乙和化合物戊能以任意比相溶,根据“相似相溶”的经验规律可推测化合物乙是分子(填“极性”或“非极性”)。
(4)阅读甲的用途图,回答下列问题:
①实验 室用甲作干燥剂,这是利用甲的性;甲在制TNT炸药的反应中的主要作用是。
室用甲作干燥剂,这是利用甲的性;甲在制TNT炸药的反应中的主要作用是。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废 液中提纯并结晶出绿矾晶体(
液中提纯并结晶出绿矾晶体(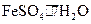 )。
)。
Ⅱ.将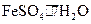 配制成溶液。
配制成溶液。
Ⅲ. 溶液与稍过量的
溶液与稍过量的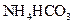 溶液混合,得到含
溶液混合,得到含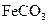 的浊液,同时有
的浊液,同时有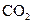 气体放出。
气体放出。
Ⅳ.将浊液过滤,用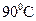 热水洗涤沉淀,干燥后得到
热水洗涤沉淀,干燥后得到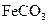 固体。
固体。
V.煅烧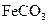 ,得到
,得到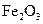 固体。
固体。
(1)Ⅰ中,加足量的铁屑除去废液中的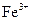 ,该反应的离子方程式是。
,该反应的离子方程式是。
(2)Ⅱ中,需加一定量的稀硫酸。运用化学平衡原理,结合化学用语简述硫酸的作用?
(3)Ⅲ中,生成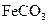 的离子方程式是。
的离子方程式是。
(4)Ⅳ中,通过检验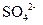 来判断沉淀是否洗涤干净。请写出检验方案(操作、现象和结论)
来判断沉淀是否洗涤干净。请写出检验方案(操作、现象和结论)
(5)已知煅烧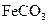 的化学方程式是
的化学方程式是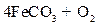
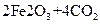 ,现煅烧464.0
,现煅烧464.0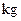 的
的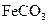 ,得到316.8
,得到316.8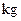 埏产品。若该产品中杂质只有
埏产品。若该产品中杂质只有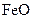 ,则产品中
,则产品中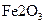 的质量是
的质量是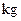 .
.
下图表示几种中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为黑色的非金属固体单质,D可使品红溶液褪色,E在通常状况下是无色无味的液体,G是淡黄色的固体化合物,H是黑色晶体。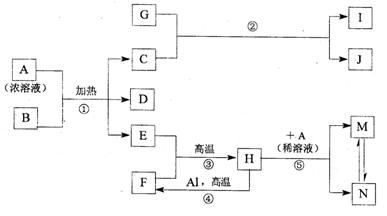
请回答下列问题:
(1)单质F的组成元素在周期表中的位置是(指明周期和族),G的电子式为,化合物Ⅰ的俗名。
(2)金属Al和H的混合物俗称,引发该反应的操作是。
(3)镁条能在气体C中燃烧得到两种固体,其化学式分别是、;
(4)写出上图中下列反应的化学方程式:
①;
③;
(5)向上图中的反应⑤得到的M、N混合液中通入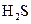 气体,溶液变浑浊,酸性增强。请写出该过程发生反应的离子方程式:。
气体,溶液变浑浊,酸性增强。请写出该过程发生反应的离子方程式:。
某同学将一废旧电解单元槽改装成如图装置,其中间的膜可以自由更换。
(1)若K处于打开状态,膜为半透膜,Ⅰ室内加入KI淀粉溶液,Ⅱ室内加入等体积的含有稀硫酸的双氧水,一段时间后可观察到的现象是(填字母序号)
| A.Ⅰ室内溶液变蓝 |
| B.Ⅱ室内溶液变蓝 |
| C.Ⅰ、Ⅱ室内溶液都变蓝 |
| D.Ⅰ、Ⅱ室内溶液都不变蓝 |
(2)若膜为阳离子交换膜(只允许阳离子自由通过且不易堵塞),Ⅰ室内加入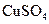 溶液,Ⅱ室内加入等体积NaCl溶液。K闭合后,开始一段时间内,Ⅰ室电极上的电极反应式为,Ⅱ室电极上的电极反应式为。
溶液,Ⅱ室内加入等体积NaCl溶液。K闭合后,开始一段时间内,Ⅰ室电极上的电极反应式为,Ⅱ室电极上的电极反应式为。
(3)若K处于打开状态,膜为阴离子交换膜(只允许阴离子自由通过且不易堵塞),Ⅰ室内加入0.1mol/L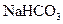 溶液,Ⅱ室内加入0.1mol/L NaOH溶液,装置内发生反应的离子方程式为。一段时间后,关闭K,则装置中Ⅰ室内产生的气体为(填化学式),Ⅱ室内产生的气体为(填化学式)。
溶液,Ⅱ室内加入0.1mol/L NaOH溶液,装置内发生反应的离子方程式为。一段时间后,关闭K,则装置中Ⅰ室内产生的气体为(填化学式),Ⅱ室内产生的气体为(填化学式)。