图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。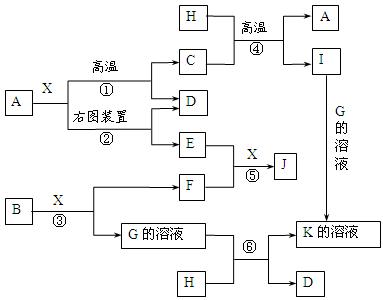
请 按要求填空:
按要求填空:
⑴写出B的化学式: 。
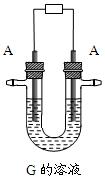
⑵写出用A作电极电解G溶液,在电极上生成E的反应式: ,反应⑤的现象是 。
⑶反应①的化学方程式是 ,
反应④在生产中有重要应用,被称为 反应。
⑷反应⑥的离子方程式是 。
下图为两套实验装置。
(1)写出下列仪器的名称: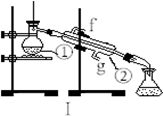

① ;② 。
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是 ,将仪器补充完整后进行的实验操作的名称为: ,冷却水从 口进。
(4)某学生欲用11.9 mol/L浓盐酸和蒸馏水配制480mL物质的量浓度为0.400 mol/L的稀盐酸.
①其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 、 。
②将下列操作填写完整,并排列其正确的操作顺序(字母表示,每个字母只用一次)_ _ _ _;
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
| B.用量筒准确量取浓盐酸_________ mL,注入烧杯中,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其混合均匀 |
| C.将已冷却的盐酸沿玻璃杯注入_________ 中 |
| D.将容量瓶盖紧,颠倒摇匀 |
E.改用_________ 加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度线_________ 处.
③若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?________
④在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
a没有洗涤烧杯和玻璃棒
b转移溶液时不慎有少量溶液洒到容量瓶外面
c容量瓶不干燥,含有少量蒸馏水
d定容时俯视刻度线
e定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25 mL沸水中逐滴加入1 mL~2 mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是 ________;若丙同学实验中不停止加热,会看到____________________。
(2)证明有Fe(OH)3胶体生成的实验操作及现象是_____________________。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明________________________________。
②向其中加入过量稀硫酸,产生的现象是__________________。
实验室里要配制465 mL 0.2 mol/L的硫酸钠溶液。
(1)请填写下列空白:
| A.计算、称量、溶解:在天平上称出________g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。 |
| B.转移:把得到的溶液冷却后小心地沿着________注入________中。 |
| C.洗涤:用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。 |
| D.定容:继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线相切。 |
E.摇匀:将瓶塞塞紧,充分摇匀。
F.贴标签、装试剂瓶:将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(2)下列情况会使所配溶液浓度偏高的是________(填字母)。
a.某同学定容时俯时容量瓶刻度线
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线又加水了
d.进行B操作时将少量液体洒到外面
e.未冷却至室温就进行转移
实验室用MnO2和浓盐酸反应制取Cl2,发生装置如图A。



回答下列问题:
(1)仪器a的名称是 。
(2)书写实验室制备氯气化学方程式
(3)制得的气体除去HCl杂质后,为得到干燥的Cl2,应通过 装置(填 “B” “C”或“D”)。
(4)若制得氯气0.56L(标准状况),则被氧化的HCl的物质的量_________mol,并将所得氯气与过量的石灰乳反应,则理论上最多可制得______________g次氯酸钙。
(5)漂白粉在空气中长期放置失效的化学方程式 、 。
实验室欲配制480 mL 0.1 mol•L-1 Na2CO3溶液,请据此回答下列问题:
(1)实验时,应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 。(填字母)
| A.容量瓶内壁附有水珠而未干燥处理 |
| B.忘记将洗涤液加入容量瓶 |
| C.定容时俯视刻度线 |
| D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切 |