实验室欲配制480 mL 0.1 mol•L-1 Na2CO3溶液,请据此回答下列问题:
(1)实验时,应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 。(填字母)
| A.容量瓶内壁附有水珠而未干燥处理 |
| B.忘记将洗涤液加入容量瓶 |
| C.定容时俯视刻度线 |
| D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切 |
盛极一时一种实验室常用的化学试剂,请按要求填空: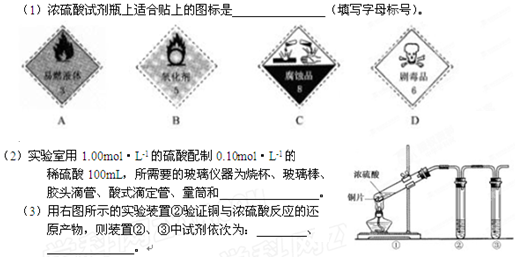
(4)装置①的反应方程式
若装置①中加入铜6.4克和含有0.2摩尔硫酸的浓硫酸产生二氧化硫
A等于6.4克 B 大于6.4克 C 小于6.4克 D不能确定
化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到的实现现象是___________,②反应过程中发生反应的化学方程式是。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有FeO42-)。
Ⅱ.SCN-的电子式为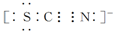
III.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式__________。
②第二种假设是:____________,提出该假设的理论依据是___________________
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如 下:
下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):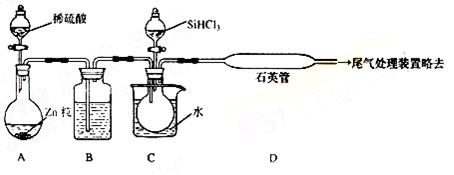
①装置B中的试剂是 ,装置C中 的烧瓶需要加热,其目的是: 。
的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生 反应的化学方程式为 。
反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量 铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水b.氯水 c.NaOH溶液d.KSCN溶液e.Na2SO3溶液
钢铁工业是国家工业的基础,是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是。
(2)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。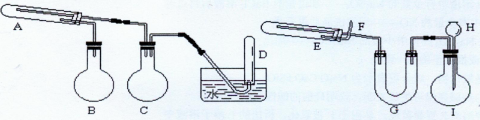
填写下列空白:
①实验进行时试管A中应加入的试剂是;烧瓶B的作用是;烧瓶C的作用是。
②实验时,U型管G中加入的试剂是;长颈漏斗H中应加入。
③试管E中发生反应的化学方程式是。
④为了安全,在E管中的反应发生前,在F出口处必须。
为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。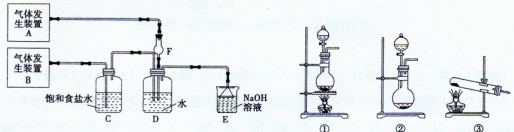
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是;气体发生装置B应选择①、②、③三种装置中的(选填序号)。
(2)D装置中主要反应的离子方程式为:。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有(试剂名称,下同)的试管中,再加入产生的现象是,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有的试管内,产生的现象是。