水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点/℃ |
16.6 |
-89.5 |
-73.5 |
| 沸点/℃ |
117.9 |
117 |
126.3 |
| 密度/g·cm-3 |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
互溶 |
不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是: ;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③ 。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液 C.饱和Na2CO3溶液
D. 饱和 K2CO3溶液 E. 饱和KOH溶液 F.过量的 1-丁醇
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。根据所学知识,回答下列问题:
⑴工业上将氯气通入石灰乳制取漂白粉,反应的化学反应方程式为;漂白粉有效成分为(填名称);瓶装漂白粉久置空气中会呈稀粥状而失效,试用化学方程式表示失效的原因。
(2)某化学兴趣小组为了探究HClO的漂白性,设计了如下的实验。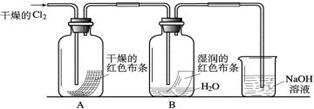
a.通入Cl2后,从集气瓶A、B的现象可得出的结论是;其中发生的反应的化学方程式为。
b.为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是。
c.烧杯中溶液所起的作用是,烧杯中所发生反应的化学方程式为。
d.为保证实验安全,氯气以每分钟1.12L(已换算为标准状况下)的流速匀速通入,若实验需耗时4分钟,小烧杯中盛放2 mol·L—1的NaOH溶液的体积至少应为 mL。
mL。
现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
(2)经计算,需浓H 2SO4的体积为。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填序号)
2SO4的体积为。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是。(填序号)
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到mL的容量瓶中,转移时应用玻璃棒。转移完毕,用少量蒸馏水洗涤2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水注入容量瓶直到液面接近刻度处。改用滴加蒸馏水到瓶颈刻度的地方。振荡摇匀后,装瓶贴签。
(4)在配制过程中,其他操作都准确,下列操作中错误的是(填序号,以下同),能引起误差偏高的有。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)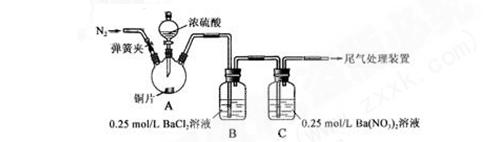
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚 未发现白色沉淀溶解 未发现白色沉淀溶解 |
(1)A 中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气中成分共同作用,乙认为是只有白雾参与反 应。
应。 ①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶 于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____________。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是▲
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认 为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选
为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选 用▲ (选填序号)。
用▲ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为▲。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。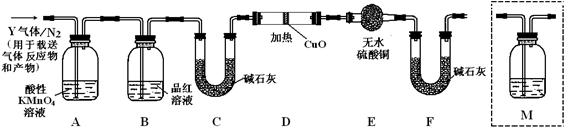
(3)装置B中试剂的作用是▲
(4)分析Y气体中的Q2气体是如何生成的▲(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于▲(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是▲
某同学用下面装置实现铜与浓、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按下图所示连接仪器、检查气密性、装入化学试剂。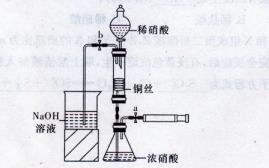
(1)过程I发生反应的离子方程式是______________________。
(2)过程Ⅱ将铜丝做成螺旋状的目的是______________________。
(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触.操作是______________________。当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。
②换入另一注射器后,打开b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体产生。稀硝酸充满玻璃管的实验目的是______________________。
(4)已知:NO+NO2+2NaOH2NaNO2+H2O;2NO2+2NaOHNaNO3+NaNO2+H2O,NO和NO2的混合气体的组成可表示为NOx。将该混合气体通人NaOH溶液被完全吸收时,x的取值范围应为______________。