Ⅰ.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中,发生反应:2A(g)+B(g)  2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为 ;该条件下的反应的平衡常数为 。
2C(g).反应开始时可滑动的活塞的位置如甲图所示,当反应达到平衡时,活塞位置如乙图所示。则当达到平衡时,A的转化率为 ;该条件下的反应的平衡常数为 。
Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的热化学方程式 。
(2)利用该反应可设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式 。
(3)用石墨做阳极,铁棒做阴极,电解硫酸铜溶液,则石墨棒上的电极反应式为 ;如果起始时盛有1000mL PH=5的硫酸铜溶液(25℃)(足量),一段时间后溶液的PH变为1,若要使溶液恢复到起始浓度(忽略溶液体积变化),可向溶液中加入 (填物质名称),其质量约为 。
在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2 2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:
2SO3,ΔH<0,已知常压下平衡混合气体中SO3体积分数为91%。试回答:
(1)在生产中常用过量的空气是为了____________________________________。
(2)加热到400℃~500℃是由于_____________________________________。
(3)压强采用______________,原因是__________________________________。
(4)常用浓H2SO4来吸收SO3而不用水,因为____________________________。
制取硝酸铵的流程图如下: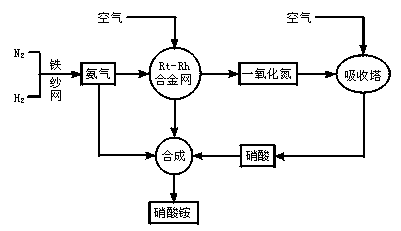
请回答下列问题:
(1)合成氨的原料通常各来自何处?
(2)已知N2(g)+3H2(g) 2NH3(g),Q>0。请解释:
2NH3(g),Q>0。请解释:
①什么是可逆反应?
②为有效提高氨的产率,实际生产中宜采取哪些措施?
(3)写出氨催化氧化的化学方程式。铂—铑合金网有何作用?为什么铂铑合金网未预热也会发热?
(4)举出硝酸铵的两种主要用途。解释为什么该用途对现代社会非常重要?
(5)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
(6)请你为硝酸厂的选址提出合理化建议。
在一恒容密闭容器中发生某化学反应2A(g)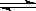 B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示: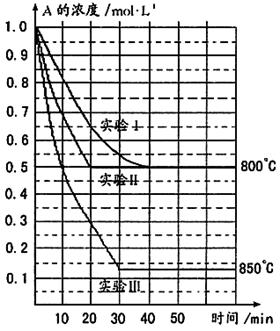
试回答下列问题:
(1)在实验Ⅰ中,反应在20min至40min内A的平均反应速率为___________mol·L-1min-1。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_____________________________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol·L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:
I2(g) + H2(g)  2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
(1)达平衡时,I2(g)的物质的量浓度为写出该反应的平衡常数表达式 _____________________________________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是,则乙条件可能是。
(填入下列条件的序号)
①恒容条件下,升高温度; ②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积; ④恒温条件下,扩大反应容器体积; ⑤恒温恒容条件下,加入适当催化剂。
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 |
金属 质量/g |
金属 状态 |
C(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失 的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)本实验中影响反应速率的其他因素还有,其实验序号是。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: