 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:


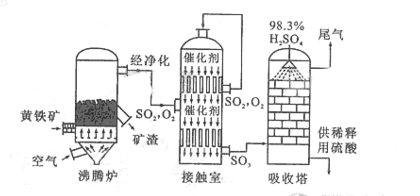

 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整
 4+11
4+11
 (2)接触室中发生反应的化学方程式是。
(2)接触室中发生反应的化学方程式是。
 (3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)。
 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎
 b. 过量空气能提高的转化率
b. 过量空气能提高的转化率
 c. 使用催化剂能提高的反应速率和转化率
c. 使用催化剂能提高的反应速率和转化率
 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁
 (4)每160g气体与
(4)每160g气体与 化合放出260.6的热量,该反应的热化学方程是。
化合放出260.6的热量,该反应的热化学方程是。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的和铵盐。
 ①既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的。吸收的离子方程式是。
①既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的。吸收的离子方程式是。
 ② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00相同浓度的溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00相同浓度的溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
 部分测定结果;
部分测定结果;
 铵盐质量为10.00和20.00时,浓硫酸增加的质量相同;铵盐质量为30.00时,浓硫酸增加的质量为0.68;铵盐质量为40.00时,浓硫酸的质量不变。
铵盐质量为10.00和20.00时,浓硫酸增加的质量相同;铵盐质量为30.00时,浓硫酸增加的质量为0.68;铵盐质量为40.00时,浓硫酸的质量不变。
 计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00。 浓硫酸增加的质量为。 (计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是%; 若铵盐质量为15.00。 浓硫酸增加的质量为。 (计算结果保留两位小数)
高锰酸钾是中学常用的试剂.工业上用软锰矿制备高锰酸钾流程如下.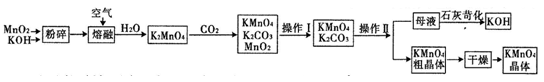
(1)铋酸钠(不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式 .
(2)KMnO4稀溶液是一种常用的消毒剂.其消毒原理与下列物质相同的是 (填代号).
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有 、 (写化学式).
(4)理论上(若不考虑物质循环与制备过程中的损失)1mol MnO2可制得 mol KMnO4.
(5)该生产中需要纯净的CO2气体.写出实验室制取CO2的化学方程式 ,所需气体产生装置是 (选填代号).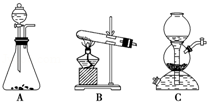
(6)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体.
(1)下列物质: ①Na ②Br2 ③Na2O ④NH3 ⑤CO2 ⑥蔗糖 ⑦NaCl晶体 ⑧KCl溶液 ⑨H2SO4 ⑩Ba(OH)2 ,其中属于电解质的是 ,属于非电解质的是 。 (用序号填写)
(2)从Ba(OH)2 、HCl 、Zn 、CuSO4、CaCO3中选出合适的物质,实现下列各题要求的变化,写出化学反应的离子方程式。
①实验室制取CO2的反应 。
②实验室制取H2的反应 。
③生成沉淀的反应 。
(1)0.5mol SO2,所含有的分子数约为 个,质量为 。 等质量的O2和O3所含的原子个数之比是 ____。 标准状况下,2mol NH3与_______g CO2的体积相等。
(2)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的摩尔质量为____
(3)在_____mL 0.2 mol/L NaOH溶液中含2 g溶质;实验室使用的浓盐酸质量分数为36.5%,密度为1.19g/mL,则该浓盐酸的物质的量浓度为 mol/L。
某次实验需用0.4 mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯 次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面_____________时,改用___________加蒸馏水至 盖好瓶塞,上下颠倒.混合均匀.
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| B.配制溶液所用的容量瓶洗净后没有烘干 |
| C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
| D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
E .最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F. 定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
在反应3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O中:
(1)_________元素化合价升高,_________元素化合价降低。(填元素名称)
(2)_________是氧化剂,Cu发生了_________反应,_________是氧化产物
(3)用双线桥法表示该反应电子得失的方向和数目:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O