乙炔是有机合成工业的一种原料。工业上曾用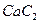 与水反应生成乙炔。
与水反应生成乙炔。
(1)将乙炔通入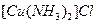 溶液生成
溶液生成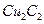 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为 。
基态核外电子排布式为 。
(2) Ca2+的原子结构示意图: ;已知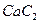 中
中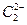 与
与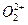 互为等电子体,
互为等电子体,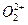 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol 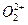 中含有的
中含有的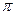 键数目为 。
键数目为 。
(3)乙炔与氢氰酸反应可得丙烯腈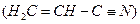 。丙烯腈分子中碳原子轨道杂化类型
。丙烯腈分子中碳原子轨道杂化类型 是 ;分子中处于同一直线上的原子数目最多为 。
是 ;分子中处于同一直线上的原子数目最多为 。
(4)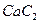 晶体的晶胞结构与
晶体的晶胞结构与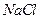 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但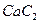 晶体中含有的哑铃形
晶体中含有的哑铃形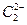 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。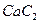 晶体中1个
晶体中1个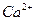 周围距离最近的
周围距离最近的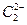 数目为 。
数目为 。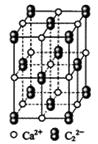
下列说法中正确的一组是()
| A.H2和D2互为同位素; |
B. 和 和 互为同分异构体; 互为同分异构体; |
C.碳链为 与 与 的烃为同系物 的烃为同系物 |
| D.金刚石、石墨和“足球烯”C60为同素异形体 |
有A、B两种烃,所含碳元素的质量分数相同,关于A和B叙述中正确的是:( )
A.二者不可能是同系物 B.二者一定是同分异构体
C.二者最简式相同
D.各1mol的A和B分别燃烧生成CO2的质量一定相等
1.92g  投人到一定量的浓
投人到一定量的浓 中,
中, 完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的
完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的 ,恰好使气体完全溶于水,则通入
,恰好使气体完全溶于水,则通入 的体积为()
的体积为()
| A.504 mL | B.336 mL | C.224 mL | D.168 mL |
室温下,VaLpH=a的强酸与VbLpH=b的强碱溶液混合,混合后溶液pH=3。已知a+b=13,Vb=4.5Va ,则a值为
| A.2 | B.3 | C.4 | D.5 |
为了鉴别两瓶未贴标签的等体积的pH=2的醋酸溶液和pH=2的盐酸溶液,下列方案中可行的是:
| A.向等体积的两溶液中分别滴入Na2CO3溶液 |
| B.向等体积的两溶液中分别加入NaOH溶液 |
| C.向等体积的两溶液中分别滴入1-2滴紫色石蕊试液 |
| D.取等体积的两种溶液,用蒸馏水分别稀释100倍,再用pH试纸测pH值 |