25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+ O2(g)="CO(g)" △H=" -393.5" kJ/mol O2(g)="CO(g)" △H=" -393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g)△H="+571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=" -890.3" kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=" -1" 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=" -1" 400 kJ/mol |
己知:HCN(aq)与NaOH(aq)反应的DH= -12.1kJ/mol;HCl(aq)与NaOH(aq)反应的DH= -55.6kJ/mol。则HCN在水溶液中电离的DH等于
| A.-67.7 kJ/mol | B.-43.5 kJ/mol |
| C.+43.5 kJ/mol | D.+67.7 kJ/mol |
某温度下,在体积为5L的密闭容器中,充入1molA气体,发生如下可逆反应: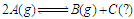 ,2min后反应达到平衡, A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是
,2min后反应达到平衡, A为0.4mol。当改变反应条件时符合如图的变化(P0表示1个大气压)。则下列叙述中不正确的是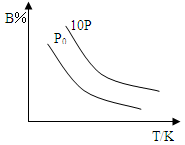
| A.0~2min时间内B物质的平均反应速率为0.03mol/(L·min) |
| B.该反应的正反应是放热反应,且C为非气体物质 |
| C.达到平衡后,保持温度和容器体积不变,再充入1 molA, 平衡向正反应方向移动 |
D.若温度和容器体积不变,起始时充入B和C各0.5mol ,则达到平衡时,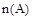 小于0.4mol 小于0.4mol |
在密闭容器中,对已达到化学平衡的反应: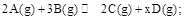 (正反应为放热反应),其他条件不变,则下列说法正确的一组是
(正反应为放热反应),其他条件不变,则下列说法正确的一组是
①恒温恒容条件下,充入不参与反应的气体He,平衡不移动,各种气体的体积分数不变
②恒温恒压条件下,充入不参与反应的气体He,平衡正向移动,则可知x>3
③恒容条件下,给体系升温,正反应速率和逆反应速率都增大,逆反应速率增大得多些
④恒容条件下,给体系降温,混合气体的平均相对分子质量一定增大
⑤改变某一条件,使平衡正向移动,则反应物A的转化率一定增大
⑥加压压缩容器体积,平衡先逆向移动,后又正向移动,则C或D至少有一种变为非气态
⑦改变某一条件,只要平衡正向移动,则逆反应速率一定减小
| A.①③⑤ | B.②④⑥ | C.②③⑥ | D.③⑤⑦ |
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。下列说法正确的是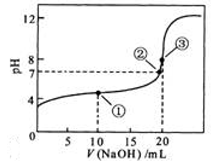
| A.滴定过程中可能出现:c(CH3COO-)>c(Na+)>c(CH3COOH)>c (H+)> c(OH-) |
| B.点①所示溶液中酸的中和率大于50% |
| C.点②是二者恰好中和点 |
| D.点③所示溶液中:c(Na+)> c(OH-)> c(CH3COO-)>c (H+) |
光谱研究表明,易溶于水的SO2所形成的溶液中存在着下列平衡: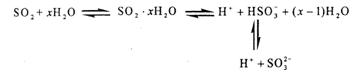
据此,下列判断中正确的是
| A.向该溶液中加入足量的酸都能放出SO2气体 |
| B.该溶液中存在着SO2分子 |
| C.该溶液中H+浓度是SO32-浓度的2倍 |
| D.向该溶液中加入过量NaOH可得到Na2SO3 、NaHSO3和NaOH的混合溶液 |