用实验确定某酸HA是弱电解质。两同学的方案是:
甲:①称取一定质量的HA配制0.l mo1·L-1的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
[化学──选修3:物质结构与性质](15分)
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为。镝(Dy)的基态原电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是。
几种稀土元素的电离能(单位:kJ·mol-1)
| 元素 |
I1 |
I2 |
I3 |
I1+I2+I3 |
I4 |
| Sc(钪) |
633 |
1235 |
2389 |
4257 |
7019 |
| Y(钇) |
616 |
1181 |
1980 |
3777 |
5963 |
| La(镧) |
538 |
1067 |
1850 |
3455 |
4819 |
| Ce(铈) |
527 |
1047 |
1949 |
3523 |
3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为,1mol CH2=CH2中含有的σ键数目为。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为,列式表示Ce(铈)单质的密度:g·cm-3(不必计算出结果)
【化学——选修2化学与技术】(15分)
(一)下列叙述正确的是()
| A.合成氨的“造气”阶段会产生废气 |
| B.电镀的酸性废液用碱中和后就可以排放 |
| C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗 |
| D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染 |
(二)工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:。
(2)用碱液浸出产品比用热水更好,理由是。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。
为使除汞达到最佳效果,应控制条件是。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=mol·L-1。
[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在;该电极pH将(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因。
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| Ksp |
2.2×10-20 |
4.0×10-38 |
8.0×10-16 |
1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为(用化学式表示)。
(2)实验室制备氨气的化学方程式为。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=,平衡时N2的转化率α(N2)=。若再增加氢气浓度,该反应的平衡常数将(填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量(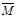 )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是。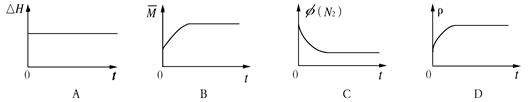
(14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3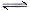 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是,该温度下H3PO3电离平衡的平衡常数K=。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为。
②产品室中生成亚磷酸的离子方程式为。
【化学—选修5:有机化学基础】以下是合成香料香豆素的路径图: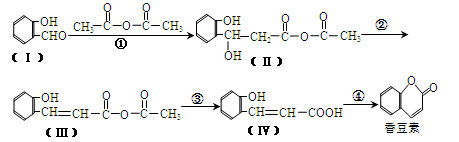
(1)香豆素的分子式为。
(2)Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为。
(3)反应②的反应类型是。
(4)反应④的化学方程式是。
(5)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。Ⅴ的结构简式为。
(6)一定条件下,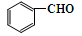 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为。
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为。