能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
右图是反应I反应过程中的能量变化曲线。
(1)由右图可知反应I为 反应(选填”吸热、放热”),反应热△H1= 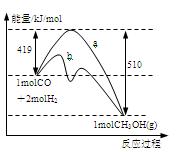
(2)反应I在一定体积的密闭容器中进行,能判断其是否达到化学平衡状态的依据是 。
| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(CH3OH) | D.c(CO)=c(CH3OH) |
(3)图中曲线 表示使用催化剂时反应的能量变化。
(4)一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数数
K值= (用分数表示),若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡时CH3OH的转化率为 ,若平衡后在充入4 mol的N2,则C(CO2)是 。
(5)从绿色化学的角度比较上述两种方法,符合原子经济的是 。(填“I” 或“II”)
(14分)酯类物质A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。
回答下列问题:
①B的分子式为C2H4O2,分子中只有一个官能团。则B的结构简式是________,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是________________________,该反应的类型是________;写出两种具有醛基(—CHO)的B的同分异构体的结构简式________________________________。
②C是芳香族化合物,相对分子质量为180。其碳的质量分数为60.0%,氢的质量分数为4.44%,其余为氧,则C的分子式是________。
③已知C的苯环上有三个取代基。其中一个取代基无支链,且含有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是________,另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是________________。如果只变化物质C苯环上三个取代基的位置,则可以得到________种C的同分异构体。
[物质结构与性质]
已知X、Y和Z三种元素的原子序数之和等于48。X的一种1:1型常见气态氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单位为正方体(如右图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
(1)Y在周期表中位于______________;Z4+的核外电子排布式为______________;
(2)X的该种氢化物分子构型为___________,X在该氢化物中以___________方式杂化。X和Y形成的化合物的熔点应该_____(填“高于”或 “低于”)X的该氢化物的熔点。
(3)①制备M的化学反应方程式是________________________________________;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的______;
③在M晶体中,Z4+的氧配位数为________;
[物质结构与性质]
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① |
|||||||||||||||||
| ② |
③ |
④ |
⑤ |
⑥ |
|||||||||||||
| ⑦ |
⑧ |
||||||||||||||||
| ⑨ |
⑩ |
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是_______。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是,被氧化的元素是。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(4)生成0.5mol还原产物时,转移的电子的物质的量为mol。
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为。
同学们已经学习了几种典型的有机化学反应类型,如取代反应、加成反应,请写出下列反应的化学反应方程式,并判断其反应类型。
(1)乙烯与溴的反应: ,属于 反应;
(2)由乙烯制聚乙烯: ,属于 反应;
(3)由苯制取溴苯:,属于 反应;
(4)由苯制取环己烷: ,属于 反应;