①化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与三氯化铁溶液发生显色反应。“HQ”还能发生的反应是 (选填序号)。
①与金属钠反应 ②水解反应 ③加聚反应 ④与溴水反应 ⑤与碳酸钠反应
②已知,1,3—丁二烯的一类二烯烃能发生与具有双键的化合物进行1,4—加成反应生成环状化合物,这类反应称为双烯合成,例如: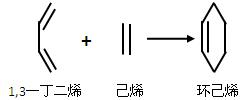
在下列横线上写出适当的反应物或生成物的键线式,完成下列反应: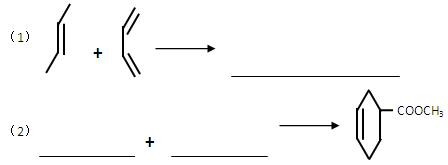
用金属钠制取Na2O通常采用下法:2NaNO2+6Na=4Na2O+N2↑根据要求回答问题:
(1)不采用Na在氧气中燃烧获得Na2O的原因是 。
(2)上述方法的优点是 。
气体A只含X、Y两种短周期元素,X的原子序数大于Y的原子序数。B、D、E是中学化学中的常见气体。各物质有如下图所示的转化关系:
试回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有( )(写化学式)
(2)若气体A的分子为线形结构,且X与Y的质量比在数值上等于X的相对原子量,则A的化学式为( )
(3)写出化学式:B________ C________ D________ E________ 甲________
实验室用二氧化锰和浓盐酸反应制取氯气。
(1)若用200mL10mol·L-1的浓盐酸与足量的二氧化锰固体加热反应(不考虑氯化挥发),则产生氯气的物质的量为0.56mol(填“大于”、“等于”或“小于”),原因是。
(2)870g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?
在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中:
(1) 元素得电子, 元素被氧化(填元素名称)。
(2)氧化产物与还原产物的粒子数目之比为_________,氧化剂与还原剂的粒子数目之比是 。
(3)若有7.3gHCl被氧化,则产生Cl2的质量为_______g。
(4)该反应的离子方程式为。
同质量的锌与盐酸反应,欲使反应速率增大,选用的反应条件正确的组合是。反应条件:①锌粒;②锌片;③锌粉;④5%盐酸;⑤10%盐酸;⑥15%盐酸;⑦加热;⑧用冷水冷却;⑨不断震荡;⑩迅速混合后静置。欲使反应速率进一步增大,可采取的措施是(列举一条)。