学习卤代烃性质时,我们知道溴乙烷在不同溶剂中与氢氧化钠发生不同类型的反应,生成不同的反应产物。我们可以通过实验的方法去验证反应的产物:
(1)在溴乙烷与氢氧化钠的乙醇溶液的 (反应类型)中可以观察到有气体生成。某同学用如下图所示装置对该气体进行验证,他所观察到的现象是 ;
(2)盛水试管的作用是 ;
(3)除了用酸性高锰酸钾溶液外,还可以用 试剂检验该气体,其反应原理是 (用化学方程式表示)。
(4)另一位同学取少量溴乙烷与氢氧化钠水溶液反应后的混合溶液,向其中滴加硝酸银溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与氢氧化钠水溶液反应,生成了溴化钠。老师和同学都认为这样不合理。若请你用实验验证该反应中生成了溴化钠,你与该同学实验方案不同的实验方法是 。
将一定量铁粒放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。
(1)为探究溶液X中铁元素的价态,设计如下实验:
药品和仪器:0.1mol·L-1KSCN溶液、0.1mol·L-1KI溶液、0.2mol·L-1酸性高锰酸钾溶液、氯水、试管和滴管。
请根据实验设计,填写下列实验报告:
| 实验步骤 |
实验操作 |
现象与结论 |
离子方程式 |
| 第1步 |
取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 |
||
| 第2步 |
若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ |
(2)为探究气体Y的组成,将盛有10mLY的量筒倒立在水槽中,待液面稳定后,再通入相同条件下3mLO2,充分反应后,量筒内完全充满溶液。则气体Y的成分及体积分别是。
无水氯化铝是一种重要的化工原料,利用明矾石 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下:
(1)验证焙烧炉产生的气体含有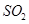 的方法是________________________________。
的方法是________________________________。
(2)吸收焙烧炉中产生的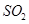 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。
(3)氯化炉中发生反应的化学方程式为_________________________________________。
(4)生产氯化铝的过程中产生 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
__________________________________________________________________________。
仪器自选;可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液②氯化亚铁溶液③硫氰化钾溶液④品红溶液
(5)某学习小组设计用如下装置验证二氧化硫的某些化学性质。
①能说明二氧化硫具有氧化性的实验现象为_____________________________________。
②写出a瓶中发生反应的离子方程式___________________________________________。
③充分反应后,取a瓶中的溶液分成三份,分别进行如下实验。
实验I:向第一份溶液中加入足量的NaOH溶液,生成白色沉淀,迅速变为灰绿色,最终变为红褐色
实验II:向第二份溶液中加入少量KMnO4溶液,紫色褪去
实验III:向第三份溶液中加入BaC12溶液,生成白色沉淀
上述实验中能证明二氧化硫具有还原性的是________(填实验代号)。
某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下:提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
I.解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需________(填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有______________(填仪器名称)。
(3)为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;
②__________________________________________________________________________。
Ⅱ.解决问题2
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:_______________________。
(2)从实验Ⅱ可得出的结论是在高温下正一价铜比正二价铜________(填稳定或不稳定),溶液中正一价铜比正二价铜_________(填稳定或不稳定)。
Ⅲ.解决问题3
设计如下装置(夹持装置未画出):
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通人灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36g,并收集到0.28g气体Y。
(1)仪器A的名称是_____________________。
(2)X的化学式为_______________________。
某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
甲同学基于假设③设计实验方案如下:
乙同学同样基于假设③设计另一实验方案如下: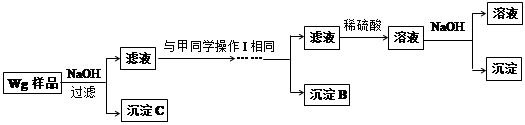
(1)Fe元素在周期表中的位置是第周期族。
(2)试剂M是;沉淀B是。
(3)你认为甲、乙同学的方案(填“甲”或“乙”)比较好,理由是。
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入,直至生成的沉淀刚好溶解,再加入足量的。
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为(填“是”或“否”)准确,原因是。
(6)电解法制金属铝的化学方程式是。
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是。
某化学研究性学习小组讨论Fe3+溶液和SO32-溶液之间发生怎样的反应,提出了两种可能,写出预计反应的离子方程式:
一是发生氧化还原反应①;二是发生互促水解反应②。
为了证明发生怎样的反应,同学们设计并进行如下实验,请填写下列空白:
实验Ⅰ:取5mLFeCl3浓溶液于试管中,逐滴加入某Na2SO3浓溶液至过量,观察到无气泡产生,无沉淀生成,但溶液颜色最终变为红褐色。这种红褐色液体是③。
向红褐色液体中逐滴加入稀盐酸至过量,可观察到溶液最终变为黄色。将所得溶液分成两等份:
其中一份加入KSCN溶液,溶液变成血红色,此步实验的目的是④;另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是⑤。
实验Ⅱ:将FeCl3和Na2SO3溶液分别稀释后,重复实验Ⅰ,产生的现象完全相同。
同学们由上述实验得出的结论是⑥。
指导老师看过上述实验步骤后认为该设计有缺陷,应在开始实验前对某主要药品进行检验,该主要药品为⑦;检验的目的是⑧。