三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 |
熔点/℃ |
沸点/℃ |
| PCl3 |
-112 |
75.5 |
| POCl3 |
2 |
105.3 |
请答下面问题:
(1)B中所装试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是 ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
| 实验步骤 |
实验现象 |
实验结论 |
| ① |
|
溶液X中含有Na+ |
| ② |
|
溶液X中含有Cl- |
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是 。

某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO。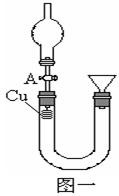
(1)补充完成下列实验步骤:
①__________________________________________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止;
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有_____色气体产生,溶液呈______色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为________________________________。
(3)试管内装有NO,倒置于水槽中,当向试管内通入21mLO2时,最后试管中的液面仍在原来的位置,则原试管中NO的体积为_________mL。
(4)0.1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量_______g。若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入2 mol·L-1的氢氧化钠溶液_mL。
实验室需要0.2mol/L CuSO4溶液250ml,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4·5H2O)②4mol/L CuSO4溶液
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是________,在使用该仪器前必须进行的操作是。
(2)若用胆矾晶体进行配制,需用托盘天平称取CuSO4· 5H2O的质量为________g;如果用4mol/L的CuSO4溶液稀释配制,需用量筒量取___________ml4mol/L CuSO4溶液。
(3)实验室用4mol/L的硫酸铜溶液稀释配制溶液所需的实验步骤有:
其中正确的操作顺序为
①往烧杯中加入约100ml水进行初步稀释,冷却至室温
②用量筒量取一定体积4mol/L 的硫酸铜溶液于一烧杯中
③计算所需4mol/L 硫酸铜溶液的体积
④将溶液颠倒摇匀后转存于试剂瓶
⑤加水至液面离容量瓶1-2cm处改用胶头滴管进行定容
⑥洗涤烧杯和玻璃棒2-3次并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀
⑦将溶液转移入容量瓶
(4)配制溶液过程中,如果出现以下情况,对结果有何影响(填“偏高”、“偏低”或“无影响”)
A.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
B.定容时俯视刻度线
C.容量瓶未干燥即用来配制溶液
(5)实验过程中用到蒸馏水。如图为实验室制取蒸馏水的装置示意图。图中的两处明显的错误是 ______________________________;_______________________________。实验时A中除加入少量自来水外,还需加入少量_______,其作用是防止暴沸。
某次实验需用0.4 mol/L NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;用少量蒸馏水洗涤烧杯次,洗涤后的溶液一并转入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;向容量瓶中加入蒸馏水,到液面_____________________时,改用__________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.所用的NaOH中混有少量Na2O |
| B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| C.配制溶液所用的容量瓶洗净后没有烘干 |
| D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视,直到最后加入一滴盐酸后,溶液由色变为,且为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则反应消耗盐酸的体积为________ mL,
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 |
待测NaOH溶液的体积/mL |
0.100 mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.20 |
20.22 |
|
| 第二次 |
25.00 |
0.56 |
24.54 |
|
| 第三次 |
25.00 |
0.42 |
20.40 |
依据上表数据求得NaOH溶液的物质的量浓度为。
某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:
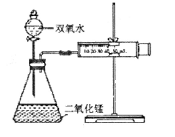
分析表中数据回答下列问题,
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而____________。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入_____g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确_______理由是_________________。