某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计实验方案.验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是 。
(2)乙同学认为方案2得到的结论正确,白色物质为 。
(3)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。
(4)钠在二氧化碳中燃烧的化学方程式为 。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_____________。
(2)在烧瓶中配制一定比例的乙醇和浓硫酸的混合液的方法是:__________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?______________,原因是____________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。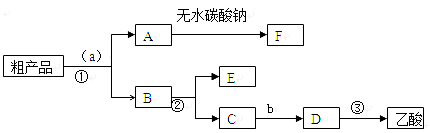
试剂a是__________,试剂b是__________;分离方法①是__________,分离方法②是__________,分离方法③是____________。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是_________________。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。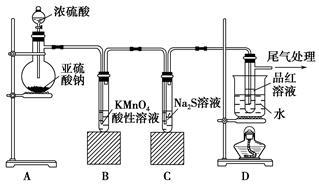
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为________________
(2)实验过程中,装置B、C中发生的现象分别是________________、________________,这些现象分别说明SO2具有的性质是____________和____________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象_________________
(4)尾气可采用__________溶液吸收。
某研究性学习小组同学设计了如下图制取氯气(药品:MnO2和浓盐酸)并验证其性质的实验装置。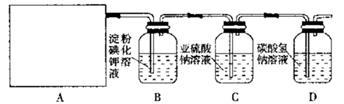
请回答下列问题:(1)该实验中A部分的装置是 (填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是 ;
整套实验装置存在的明显缺陷是 。
(3)写出D装置中发生反应的离子方程式: 。
(4)请你帮该小组同学设计一个实验,证明洗气瓶C中的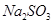 已被氧化(简述实验步骤): 。
已被氧化(简述实验步骤): 。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据下图实验装置回答问题
(1)写出下列仪器的名称:① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的是 (填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器 ,将仪器补充完整后进行的实验操作的名称为 ;②的进水口是 (填“f”或“g”)。
(4)现需配制250 mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误之处:① ;② 。
草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
【实验1】甲同学用8.00 mL 0.001 mol/L KMnO4溶液与5.00 mL 0.01 mol/L
H2C2O4溶液反应,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 |
KMnO4溶液 /ml |
H2C2O4溶液 /ml |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
| Ⅰ |
8.00 |
5.00 |
3.00 |
20 |
|
| Ⅱ |
8.00 |
5.00 |
3.00 |
30 |
|
| Ⅲ |
8.00 |
5.00 |
1.00 |
20 |
2.00 mL 蒸馏水 |
(1)如果研究温度对化学反应速率的影响,可用实验_________ 和________ 作对比(用Ⅰ~III表示)。
(2)对比实验Ⅰ和III,可以研究__________对化学反应速率的影响,实验Ⅲ中加入2.00 mL蒸馏水的目的是________________。
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
(1)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是 的影响。
(2)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 (填字母)。A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰