氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是 。
(3)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= 。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H -574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。 b是 n3 = p= 
现有乙酸、苯、苯酚、苯甲酸四种有机物组成的混合物,可按右面的图示程序进行分离(已知苯甲酸是微溶于水的白色晶体)。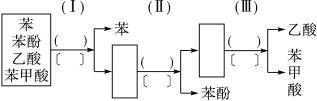
请在圆括号内填上适当的试剂名称,在方格号内填上分离操作的名称,在方框内填上适当物质的化学式。
20℃时,将10mL 0.1 mol/L  溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
溶解于酸所花的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
50 |
| E |
2 |
薄片 |
45 |
25 |
| F |
2 |
粉末 |
15 |
5 |
试求:
(1)画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(2)利用所画的曲线图,关于温度影响反应速率你能得出什么结论?
(3)20℃时,2g锌箔溶解于酸中需花多少时间?
(4)对比结果B与F,解释F为什么那么快?
下图为将Zn投入一定浓度体积的H2SO4中,解释图像的成因(纵坐标为H2的生成速率)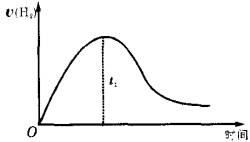
试将外界条件对化学反应速率的影响结果填入下表中。